问题分诊室
体外冲击波治疗骨关节炎及其机制研究进展
发布时间: 2024-08-15
骨关节炎是一种由机械损伤、炎症和代谢紊乱等因素导致的关节退行性疾病。体外冲击波疗法是一种可以有效缓解关节疼痛延缓关节炎症进程的临床物理治疗方法。本文从临床试验和动物模型中收集并整理体外冲击波治疗骨关节炎的相关研究,进而总结体外冲击波治疗受损软骨和重塑软骨下骨的潜在机制,为进一步改善体外冲击波治疗骨关节炎的效果提供依据。
关节炎是一种由炎症、感染、退化、创伤或其他因素引起的炎性疾病,一般发生在人体关节及其周围组织,主要临床症状为关节肿胀疼痛及功能障碍。其发病原因多为关节滑膜或软骨在受损后引发炎症,继而导致滑膜和关节软骨组织纤维化和细胞死亡。关节软骨细胞被限制在胶原蛋白和蛋白聚糖的窝陷中,导致软骨细胞无法通过血管获取所需的修复细胞和生物活性分子(如生长因子、趋化因子、促有丝分裂因子和趋细胞因子等),同时软骨细胞也无法从邻近的健康部位迁移到损伤部位。软骨损伤一般很难自愈,在损伤发生的初期较隐匿且容易漏诊,病情持续发展会对关节造成巨大伤害。软骨损伤的常规治疗方式包括药物治疗和手术治疗。药物治疗多为非甾体抗炎药的使用,该类药物会对胃肠道响及心血管产生不良影。而手术治疗会带来潜在的副作用,如不完全的生长停滞或软骨组织并发症。因此,药物治疗及手术治疗各存在弊端且会带来潜在的副作用。
近年来,体外冲击波治疗已成为有效治疗肌腱病、外上髁炎、钙化性肌腱炎、长骨骨折不愈合及股骨头缺血性坏死等肌肉、骨骼疾病的主要选择。越来越多的临床和实验证据表明,体外冲击波治疗具有以下优势:
(1)无创治疗,进行冲击波治疗时,无需进行切开、注射等操作;
(2)精准定位患处,精准定位后可避开重要神经、血管,直达病灶,避免不必要的损伤;
(3)治疗量可选择,准确调节能量,根据不同的疾病选择不同的能级范围。
冲击波具有组织损伤修复作用、组织黏连松解作用、神经末梢封闭作用、扩张血管、修复骨关节炎中的受损软骨并修正软骨下骨重塑,在一定程度上逆转关节炎进展的病理。体外冲击波治疗可能通过激活软骨细胞促进软骨再生分化,以及通过下调炎性细胞因子来缓解整个关节的慢性炎症活动(图1)。本研究从动物模型研究和临床试验中收集证据,以评价体外冲击波疗法治疗骨关节炎中受损软骨和软骨下骨的效果及其潜在的治疗机制。
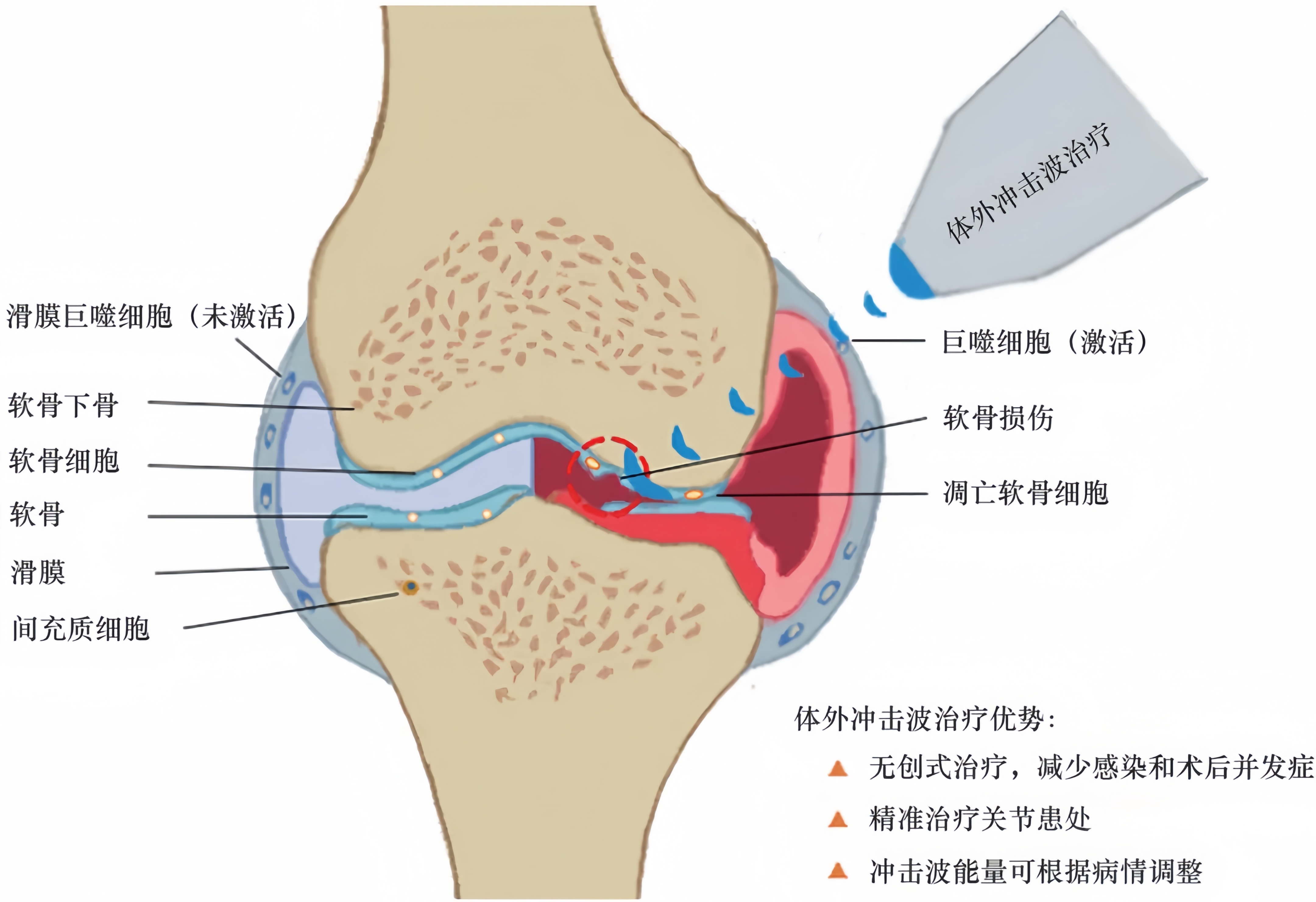
图1 体外冲击波治疗关节炎示意
1 体外冲击波在临床上的应用
近年来,体外冲击波疗法因无创、精准靶向和灵活选择治疗剂量等优点,越来越多地应用于临床治疗,疗效显著。因此,探索体外冲击波治疗对关节炎的临床治疗效果及治疗靶点至关重要。
临床数据表明,经体外冲击波治疗后转化生长因子-β(TGF-b1)、VEGF和BMP-2显著升高,骨愈合与成骨生长因子显著增加。将透明质酸(Hyaluronic acid,HA)、富血小板血浆(Platelet-rich plasma,PRP)治疗和体外冲击波疗法相结合可以促进人软骨细胞的体外再生。同时,经体外冲击波疗法和HA共处理后可以降低肿瘤坏死因子α(TNF-α)、白细胞介素-6(IL-6)和白细胞介素-17A(IL-17A)等促进分解代谢的促炎因子,并增强抗炎细胞因子白细胞介素-10(IL-10)的分泌。其中骨关节炎软骨细胞中IL-10和TNF-α的表达下调,这有可能是降解代谢产生的TNF-α的结果。而联合富血小板血浆的体外冲击波治疗虽然能够减轻关节炎患者疼痛,且疗效优于单独的富血小板血浆注射和体外冲击波治疗,但因相关研究较少,结果准确性及机制还需进一步探究。通过对低剂量体外冲击波疗法治疗轻中度膝关节骨性关节炎患者的治疗结果分析发现,大多数患者骨关节炎有较大改善,并且没有出现恶化现象。但在实验中也存在一些不良反应,例如疼痛、皮肤发红、烧灼感等,这可能与患者应激反应有关。同时,体外冲击波疗法可能会导致关节软骨水化增加,胶原纤维的完整性和方向性受损,但均在正常范围内。因此,通过临床试验可知,体外冲击波疗法可以促进细胞转化生长因子与抗炎细胞因子释放。同时,将体外冲击波疗法与透明质酸或血小板血浆联合治疗效果更好(图2)。
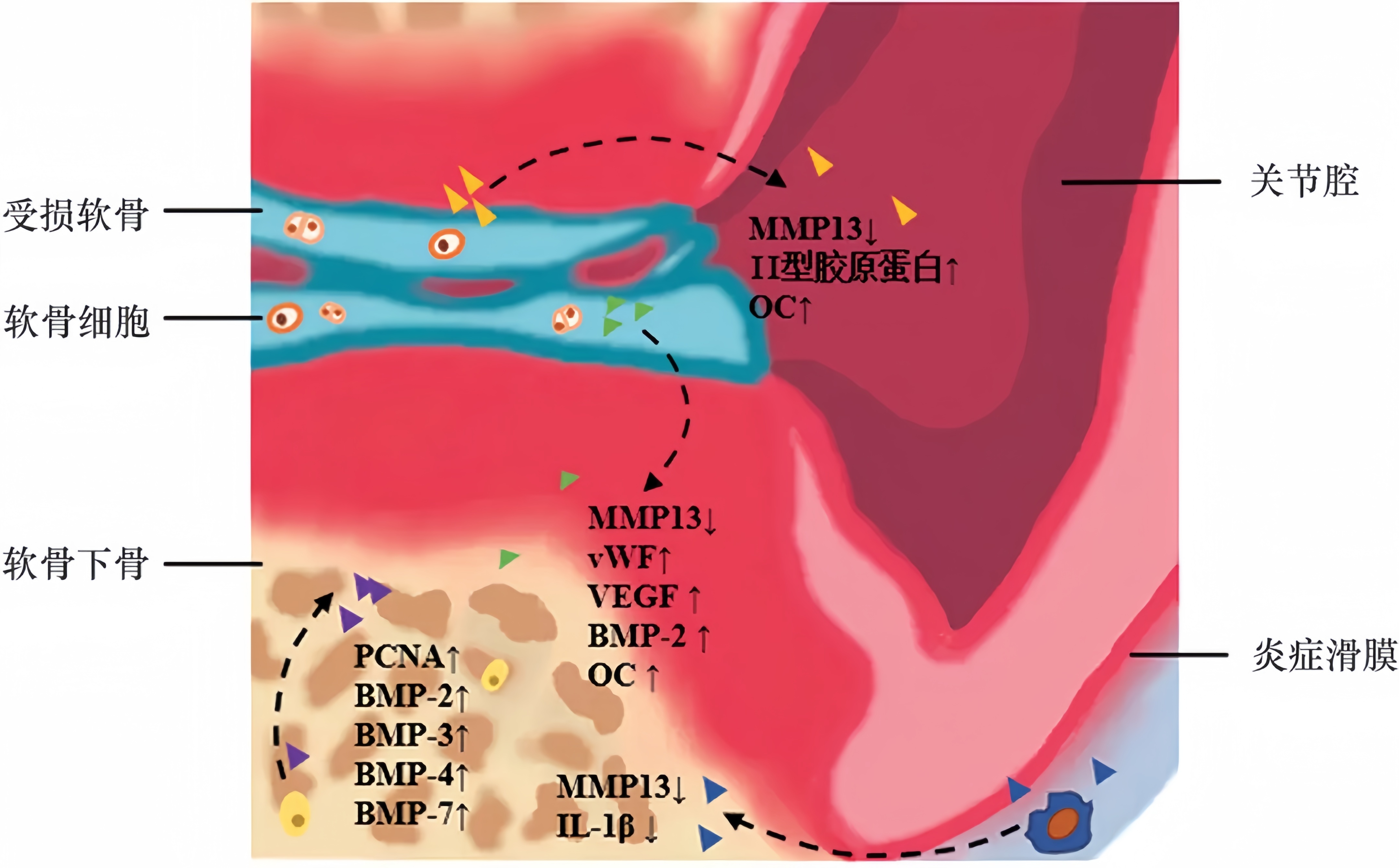
图2 体外冲击波治疗关节炎机制
1.2 冲击波治疗的重要时期与靶点
目前针对骨关节炎中软骨损伤的再生方法旨在修复局部创伤性损伤,关节炎早期是该病治疗的关键时期,而待其发展至晚期是治疗的禁忌。进一步研究表明,体外冲击波疗法虽然对早期膝关节骨性关节炎的关节软骨无明显影响,但将体外冲击波疗法分别应用于软骨下骨和关节软骨可发现,软骨下骨的IL-1β显著降低,TGF-β1和DMP-1的表达有明显升高。所以对于体外冲击波疗法治疗早期骨关节炎,软骨下骨是一个比关节软骨更好的靶点。将体外冲击波疗法应用于膝关节胫骨内侧髁的软骨下骨,可产生最大的软骨保护作用。
2 体外冲击波应用于动物软骨的治疗结果及局限
虽然现有的临床治疗结果已证明体外冲击波对骨关节炎治疗效果显著,但其中的治疗机制知之甚少。为探索其治疗机制,进一步收集了体外冲击波治疗骨关节炎的动物实验结果。
在骨关节炎发生发展过程中,软骨基质降解,软骨纤维化及钙化层的侵蚀更易发生。降解的软骨释放至滑液中,诱导滑膜炎症,进一步导致软骨退化。退化软骨结构改变,关节间隙狭窄的同时摩擦增大,进一步增加软骨损伤和疼痛。所以软骨的修复对阻止骨关节炎的发展至关重要,因此重点关注冲击波物理治疗对于软骨产生的影响。
对经体外冲击波处理后的骨关节炎大鼠关节进行组织学评价,发现治疗后Mankin评分和番红染色水平显著降低,关节软骨中基质金属蛋白酶(MMP13)降低,II型胶原蛋白显著增加。冲击波治疗后,软骨降解程度显著降低且软骨细胞活性增加,并一定程度上改善了软骨下骨重塑。此外,间充质细胞中与细胞分裂相关的蛋白质增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)表达强烈,细胞中骨形态发生蛋白(bone morphogenetic protein,BMP)BMP-2、BMP-3、BMP-4和BMP-7 mRNA的表达明显增加,将有利于刺激间充质细胞分化为成骨/软骨细胞系,并增加碱性磷酸酶和骨钙素的表达。体外冲击波疗法还可以显著降低滑膜腔的一氧化氮水平以及抗凋亡蛋白的上调,从而降低软骨细胞凋亡程度并增加软骨细胞增殖。因此,体外冲击波治疗可以通过减少软骨基质降解、促进软骨基质蛋白生成、增强软骨细胞活化增殖、减少凋亡和促进干细胞向软骨细胞分化,进而达到对受损骨关节软骨修复的目的。
软骨下骨位于关节软骨的深处,两者间通过钙化软骨相连。在骨关节炎发生的早期,软骨下骨出现显微结构的变化,软骨下骨结构重塑会加速软骨损伤的修复。而且,软骨下骨不仅是身体重要的减震器,同时也是影响关节软骨代谢的重要组织。软骨下骨的重塑异常会导致对机械负荷的缓冲能力下降,进而使关节软骨承受的机械应力增大,导致重分布微循环障碍,进而导致软骨下骨硬化阻碍软骨营养获取,并且合成的大量细胞因子及生长因子运送至软骨,加速软骨磨损和退化。因此,为改善骨性关节炎的症状,修复和重建受损的软骨和软骨下骨至关重要。在很多利用冲击波修复软骨治疗骨关节炎的实验中,往往都离不开对软骨下骨的探究。
体外冲击波疗法会在改善软骨下骨重塑的同时增强软骨保护和促进软骨修复,从而达到治疗骨关节炎的作用。体外冲击波治疗大鼠膝骨关节炎的实验发现,体外冲击波疗法和前交叉韧带横断(ACLT)共处理组相较于ACLT组的软骨下骨中血管性血友病因子(vWF)、血管内皮生长因子(VEGF)、骨形态发生蛋白(BMP-2)、骨钙素(OC)含量显著增大。这表明,体外冲击波疗法可以通过刺激软骨下骨中vWF、VEGF、BMP-2和OC的增加,进而促进成骨和血管生成,实现软骨下骨的重建。同时,蛋白质二硫键异构酶家族A,成员3(Protein Disulfide Isomerase Family A Member 3,Pdia-3)在软骨下骨中也能响应体外冲击波疗法,并且在该信号通路中细胞外调节蛋白激酶1(ERK1)的关键成分被激活。经体外冲击波治疗后的ERK信号活跃,可能在软骨下骨重建的信号通路中发挥重要作用。此外,冲击波治疗会引起软骨下骨中DKK-1(Dickkopf-related protein 1)、MMP13、Wnt-5a(Wnt Family Member 5A)和β-连环蛋白的变化,从而激活Wnt5a/Ca2+信号通路,促进软骨下骨重塑。因此,体外冲击波可以通过促进软骨下骨重建,减少软骨负荷增强软骨与软骨下骨的物质交换,减少软骨降解,增加骨性关节炎中的软骨细胞的活性。
综上所述,体外冲击波疗法可以减少软骨细胞的凋亡降解,提高软骨细胞的合成活性。同时,体外冲击波疗法也可以通过改善软骨下骨重塑,间接起到保护软骨的作用。但需要注意的是,不论是关节软骨还是软骨下骨,过高能量的体外冲击波都有可能造成负面影响。在使用过量体外冲击波的治疗过程中,大鼠关节Mankin评分显著提高,番红染色水平显示软骨中蛋白含量显著降低,MMP13明显增加,II型胶原蛋白减少,软骨下骨中vWF、VEGF、BMP-2、OC都明显降低,同时影响软骨细胞活力和膜通透性。尽管其他研究已经表明,冲击波诱导的细胞通透性增加不会对细胞活性产生负面影响且对关节软骨基质无有害影响,但是软骨细胞质膜的通透性急剧增加对软骨细胞的存活率有明显影响。并且冲击波能量过低对诱导Wnt5a表达几乎没有影响,过量体外冲击波疗法却会降低骨髓间充质干细胞(BMMSC)的活力。因此,虽然体外冲击波疗法在对骨关节炎的治疗中有着良好的效果和优势,但明确合适的治疗量是将体外冲击波治疗广泛应用的重中之重。
3 当前冲击波治疗方法的局限性及其治疗机制
一般将体外冲击波疗法按能量等级划分为低能量(0.06~0.11MJ/mm2)、中能量(0.12~0.25MJ/mm2)和高能量(0.26~0.39MJ/mm2),膝骨关节炎等软骨损伤疾病推荐能量为中、低级能量冲击,且实验表明低能量的体外冲击波疗法治疗效果更优。
通过对大鼠膝骨和胫骨处骨关节炎进行冲击波治疗发现低能量水平可能对诱导Wnt5a表达几乎没有影响,过量的体外冲击波疗法会降低BMMSC活力。而中等能量水平EWST(1.0 bar,6Hz和800s或0.219MJ/mm2,800次)可能通过激活Wnt5a/Ca2+信号通路,Wnt5a蛋白通过自分泌或旁分泌机制与卷曲(Fz)家族的成员disheveled(Dsh)结合。这将导致细胞内Ca2+浓度增加,从而激活蛋白激酶C(PKC)、磷脂酶C(PLC)和钙调蛋白依赖激酶II(Camk II)。通过一系列过程诱导活化的T细胞核内因子(NFAT)和核因子κB蛋白(NF-κB)的激活,从而启动相应序列的基因转录,促进软骨增殖。同样高剂量放射式体外冲击波治疗通过激活胰岛素样生长因子-1和NF-κB等重要调节蛋白达到促进软骨细胞增殖和细胞肥大的效果。Shen等取猪软骨细胞培养成3D微球结构,在体外用冲击波(0.15MJ/mm2,500次)处理后观察到冲击波刺激了活性氧(reactive oxygen species,ROS)的瞬时产生,随后增强了ERK1/2和p38的磷酸化。MAPK/Nrf2信号通路激活,MAPK信号的激活导致Nrf2核转位,下游血红素加氧酶-1(HO-1)和NAD(P)H醌脱氢酶1(NQO-1)基因表达增强,最终增加软骨细胞细胞外基质(ECM)合成,阻止进一步的退变、改善软骨健康。Hsu等利用实验大鼠进行蛋白质组学分析和免疫组化分析发现体外冲击波(0.18MJ/mm2,800次,4Hz)治疗提高了1α,25-二羟基维生素D3(1α,25(OH)2D3)快速膜信号通路关键因子Pdia-3的表达。当维生素D缺乏时,骨基质合成和软骨生长受到抑制。Pdia-3作为1α,25(OH)2 D3快速信号通路的重要中介物,是负责软骨细胞基质形成的关键转录因子。Pdia-3已被确定为1α,25(OH)2 D3的潜在替代膜相关受体,通过经典的维生素D受体介导的基因组通路和膜受体介导的快速反应,直接调节成骨细胞的矿化和软骨细胞的基质形成。因此,体外冲击波疗法处理的软骨细胞中Pdia-3的表达显著增加,提高软骨细胞的活性。而Mayer-Wagner等使用的能量为0.5MJ/mm2,脉冲次数为1500次的体外冲击波治疗10周后,腱糖蛋白C和chitinase-3-like蛋白1(Chi3L1)的免疫染色呈阳性,但在对照组软骨中并没有出现阳性。体外冲击波疗法后7和28d,II型胶原α1链(COL2A1)mRNA表达增加。超微结构改变显示粗面内质网扩张,细胞膜脱落,软骨细胞坏死,表明冲击波治疗不宜使用过大能量等级。但该研究的实验对象为SD大鼠,不同物种的骨和软骨的声学参数和力学性能可能不同,也可能导致实验结果存在偏差。
体外冲击波疗法应用于软骨治疗的探究并不广泛,且没有较长时间的效果评估,实验结果可能存在偶然性,且高能量的冲击波是否对骨关节炎患者体内软骨造成损伤或加大治疗风险尚不明确,最适宜的冲击波治疗方案仍需进一步探究。
4 结论
临床试验和动物模型研究都证明了体外冲击波疗法治疗骨关节炎的有效性,不论是对软骨、软骨下骨还是周围组织都有有益影响。冲击波不仅可以一定程度地修复关节软骨,同时对软骨下骨及其他组织结构同样有着不能忽视的影响。此外,体外冲击波可与其他手段联合治疗骨关节炎并达到更好效果。体外冲击波疗法在临床上的具体应用并不广泛,对其治疗效果背后机制的探究也相对模糊,加上关节炎疾病本身病因复杂,导致体外冲击波用于关节炎治疗中的剂量选择与治疗靶点没有明确标准。未来仍需不断深入探索体外冲击波的治疗效果背后可能存在的机制和适用方法,使冲击波逐渐成为治疗骨关节炎乃至其他关节疾病的有效手段。
本文作者:梁家铭,陈欣,马志燕,张颖煜,赵琳琳,刘营营,刘亚军
作者简介:梁家铭,山东第一医科大学公共卫生与健康管理学院,山东第一医科大学医学科技创新中心,硕士研究生,研究方向为骨关节炎治疗;刘营营(通信作者),山东第一医科大学医学科技创新中心,山东第一医科大学生物医学科学学院,副教授,研究方向为骨关节炎症微环境调控及治疗;刘亚军(共同通信作者),山东第一医科大学医学科技创新中心,北京积水潭医院国家骨科医学中心,北京市创伤骨科研究所,教授,研究方向为颈椎腰椎疾病的诊断与治疗,骨科导航机器人微创手术,骨科冲击波非手术治疗。