问题分诊室
自然:细胞谱系定量分析确定肝-胰-胆祖细胞命运可塑性
发布时间: 2021-09-17
作者:十一月
单细胞研究表明干细胞和祖细胞间有巨大的细胞异质性。在器官发生过程中,不同谱系状态的细胞相互混合,形成了持续的分化轨迹,并且这些细胞具有显著的可塑性。肝-胰-胆器官系统依赖于一个小的亚细胞群,会产生各种不同的组织,包括肝脏、胰腺、胆囊和肝外胆管。
为了对肝-胰-胆多器官发生过程进行进一步的解析,2021年8月25日,英国伦敦大学国王学院Francesca M. Spagnoli研究组发文题为Quantitative lineage analysis identifies a hepato-pancreato-biliary progenitor niche,利用单细胞RNA测序以及功能分析实验鉴定发现了肝-胰-胆祖细胞群中的中间祖细胞,对该细胞亚群在发育过程中持续的可塑性以及肝的快速扩张而胰-胆生长减弱的原因给出了分子以及细胞层面的解释。

肝-胰-胆器官发生过程是一个二元细胞命运决定过程。在小鼠胚胎时期E8.5天,内胚层一群祖细胞发生细胞命运分离,形成肝脏和胰胆祖细胞【1】。随后胰胆祖细胞产生腹侧胰腺和胆囊祖细胞【2】。为了对肝-胰-胆器官发生过程进行评估,作者们对不同发育时期进行了不同细胞类型标记物的检测,作者们发现肝脏细胞在发育过程中与胰胆祖细胞群相比出现显著地增加(图1)。但是通过对不同祖细胞群的比较,作者们发现两者之间增殖的活性与细胞死亡的活性并没有明显的不同。
那么两种祖细胞群之间发育过程产生差异的原因是什么呢?为了揭开这一问题的答案,作者们对肝-胰-胆祖细胞库的动态异质性进行评估,建立了一个计算机模型,该模型可以对发育不同时期的不同来源的祖细胞种群大小进行描述。作者们发现肝-胰-胆祖细胞库中细胞可以分为三大类,双潜能内胚层祖细胞、肝脏祖细胞和胰胆祖细胞。胰胆祖细胞保留了较长时期的可塑性,并在发育过程中可能获得肝脏细胞的命运,在发育早期有助于肝脏祖细胞的扩张,同时减弱胰胆的生长。
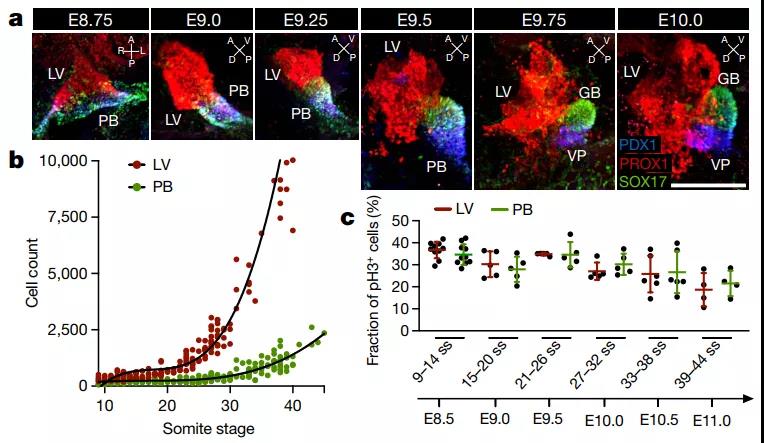
图1 肝-胰-胆器官发生过程中肝脏细胞增多而胰-胆生长减弱
通过细胞追踪实验,作者们进一步证实了胰胆祖细胞可以分离并对肝脏祖细胞的形成有帮助,而且这一形成时间会至少持续到E10.5天。为了进一步对肝-胰-胆祖细胞的身份进行确认,作者们进行了单细胞RNA-seq并且发现肝脏祖细胞中的包含两个细胞亚群,一个表现出经典的成肝细胞(Hepatoblast)的细胞特征,另外一个表现出肝脏-间质细胞杂合的特征。通过与已有的数据库【2】的对比,作者们确认了的确在发育过程中存在一个中间祖细胞库(Intermediate progenitor pool),对于胰胆以及肝脏细胞谱系均有一定的贡献。
最后,作者们想知道哪些信号通路分子对于中间祖细胞库的富集和调节有影响。通过基因本体论分析,作者们发现中间祖细胞中最丰富的是与初级纤毛组织以及Hedgehog(HH)信号通路的调控相关的信号分子。先前的研究表明,HH信号通路对于胰腺细胞命运起到拮抗作用【3】。作者们发现HH信号会作为细胞龛信号发挥作用从而帮助保护中间祖细胞储蓄库。在胰胆和肝脏边界处的中间祖细胞群会接收HH信号,从而阻止分化并维持该祖细胞群的多效性。
总的来说,该工作通过实验数据与计算机模型确定了肝-胰-胆器官发生过程中中间祖细胞群细胞命运的可塑性。中间祖细胞群驻留在特殊的细胞龛之中,使得其能够在较长的时间保持未分化的多能状态,这一定程度上解释了发育过程中肝脏的快速扩张而胰-胆生长减弱的现象。
原文链接:
#
参考文献
1 Zaret, K. S. & Grompe, M. Generation and regeneration of cells of the liver and pancreas. Science (New York, N.Y.) 322, 1490-1494, doi:10.1126/science.1161431 (2008).
2 Li, L. C. et al. Single-cell transcriptomic analyses reveal distinct dorsal/ventral pancreatic programs. EMBO reports 19, doi:10.15252/embr.201846148 (2018).
3 Hebrok, M. Hedgehog signaling in pancreas development. Mechanisms of development 120, 45-57, doi:10.1016/s0925-4773(02)00331-3 (2003).

Copyright © 2022 中国科学技术协会 版权所有 | 京ICP备16016202号-20
Copyright © 2022 中国科学技术协会 版权所有 | 京ICP备16016202号-20