问题分诊室
抗结核药物肝损伤防控策略研究报告
发布时间: 2021-05-02
结核病是严重危害人类健康的慢性传染病,是全球重大的公共卫生问题。据世界卫生组织报道,全球约有1/3~1/4的人感染了结核分枝杆菌,感染者中一生发生结核病的危险是5%~10%。2019年估算全球新发结核病患者近1000万人,我国新发结核病患者80余万人。在抗结核药物发明以前,全球结核病疫情十分猖獗,发病率高、致残率高、死亡率高。直到1944年链霉素特效抗结核药物的发明,以及随后多种一线抗结核药物的发明和使用,结核病治疗进入化疗时代,使结核病死亡率大幅度降低。
由于结核病治疗需要多种抗结核药联合使用,治疗时间长,增加了抗结核药物所引起的不良反应,其中以抗结核药物性肝损伤(drug-induced liver injury,DILI)最为常见也最为严重,导致结核病治疗中断、失败、复发及耐药性发生。DILI是结核病临床治疗的主要难点问题。通过大量的文献检索、临床实证研究以及专家共识等,提出DILI防控策略建议。
一、 抗结核药物肝损伤发生率
DILI的是指由人体使用各类化学药物、生物制剂、传统中药、天然药、保健品、膳食补充剂及其代谢产物乃至辅料但无其他感染等因素引起的肝细胞毒性损伤或肝脏对药物及其代谢产物的变态反应所致的病理过程。DILI是临床上最常见的药物不良反应之一,也是急性肝损伤最为常见的病因之一。据统计DILI占所有药物不良反应的3.0%~9.0%。一线抗结核药物如异烟肼(INH)、利福平(RIP)、吡嗪酰胺(PZA)和乙胺丁醇(EMB)所引起的不良反应中,不同国家肝损伤发生率在2%~28%之间;不同人群发生不良反应风险的差异显著。总体上看,亚洲国家较高,印度为3.8%-10%,格鲁吉亚为19%;西方国家较低,美国<1%,英国为4%,西班牙为3.3%,土耳其为3.2%。据报道我国抗结核药物引起的DILI在8%~30%之间。最近发表的大规模的DILI流行病学研究显示,我国引起肝损伤的最主要药物为抗结核药(占21.99%)、抗肿瘤药或免疫调整剂(占8.34%)。
二、抗结核药物肝损伤发生机制
抗结核DILI的发生机制通常可分为药物的直接肝损伤和特异质性肝损伤作用。直接毒性作用指摄入人体内的药物和(或)其代谢产物对肝脏产生的直接损伤,可进一步引起免疫和炎症应答等其他肝损伤机制,往往呈剂量依赖性,通常可预测;特异质性肝毒性作用指发生在少数易感人群中间的一种与药理作用及临床剂量无关的不良反应,属于超敏反应,无剂量依赖性,难以预测。
(一)INH、RIP、PZA及代谢物与直接肝损伤
异烟肼在体内的主要代谢是通过N-乙酰转移酶2(NAT2)将INH代谢为乙酰异烟肼(AcINH,约占其代谢产物的50%~90%),其中一部分的AcINH通过酶催化水解进一步转化为乙酰肼(AcHz)。另一种代谢途径是INH直接水解产生肼(Hz),接着Hz被NAT2催化变为AcHz。AcHz在排泄前变为二乙酰氢化物或者进入细胞CYP2E1 (P450 2E1)在肝脏中介导的代谢途径,产生有毒的代谢产物如乙酰偶氮等,接着被谷胱甘肽巯基转移酶(GST)催化去除。目前,普遍认为INH与其在体内产生的代谢物Hz、AcHz、AcINH与直接肝损伤相关。吡嗪酸(PA)是PZA主要代谢产物,具有较强的抗结核活性,但是PA和5-羟基吡嗪酸(5-OH-PA)可以对体外正常人肝细胞产生不同程度的肝损伤。将PZA、PA、5-OH-PA分别给予大鼠口服28d,结果与正常大鼠相比,PZA及其代谢产物降低了大鼠的体重, PA和5-OH-PA给药大鼠的肝脏形态学变化异常,表明PZA及其代谢物对肝脏有直接损伤作用,其中5-OH-PA给药组的总体损伤程度较高。而研究表明RFP的代谢产物并不产生肝损伤。
(二)细胞代谢紊乱与肝损伤
近年研究发现,INH、RFP、PZA可通过直接或间接毒性作用引起肝细胞代谢紊乱,从而发生肝损伤。RFP可通过干扰胆汁酸和胆红素的代谢来影响胆红素排泄而引起体内结合性高胆红素血症,而INH和RFP联用可造成血红素的生成途径紊乱,引起肝毒素原卟啉Ⅸ的累积而导诱导肝损伤的发生。对接受INH、RFP和PZA联用抗结核治疗的患者使用超高效液相色谱-质谱(UPLC-MS)对患者的尿液代谢物进行分析,发现患者三羧酸循环,精氨酸和脯氨酸代谢以及嘌呤代谢途径受抗结核药物的影响。
(三)线粒体、内质网应激反应与肝损伤
1.线粒体氧化应激与肝损伤
肝细胞具有丰富的线粒体,近些年来对于线粒体的研究成为肝损伤机制研究的一个热点。给予大鼠高剂量、长时间的INH后发现,与正常对照组比较,给药组尿样核磁共振氢谱发现葡萄糖和牛磺酸显著增加,2-酮戊二酸和柠檬酸显著降低,表明INH引起的肝损伤与线粒体功能受损、三羧酸循环中能量代谢异常及葡萄糖代谢紊乱有关,另一方面,INH可降低线粒体蛋白COX IV的表达,从而降低线粒体的质量并诱导线粒体ROS产生,降低大鼠肝线粒体的膜电位。
观察给予利福平的小鼠发现,随着利福平的浓度增加,电镜下可见线粒体肿胀,提示线粒体可能参与利福平诱导的肝损伤。Elmorsy等发现PZA以浓度依赖方式降低HepG2细胞的ATP水平。PZA在IC50浓度下持续作用24h能显著降低40%线粒体的膜电位水平,同样在此浓度下,能抑制33%线粒体复合物Ⅰ的活性。Elmorey也探究了PZA对HepG2细胞的毒性,与对照组相比,经PZA处理的细胞可以观察到与对照细胞相似的杆状线粒体,但也存在球形线粒体和线粒体空泡。所有这些研究都支持INH、RFP、PZA引起的肝脏损伤与线粒体的氧化应激相关。
2.内质网应激与肝损伤
内质网是蛋白质加工转运的主要场所,主要作用是维持细胞内稳态。在INH诱导的肝损伤模型中发现,在第14天与对照组比较,模型组CHOP、Caspase-12(内质网应激蛋白)表达明显增高并达到最大值,第21天较第14天下降,差异具有统计学意义。表明内质网应激介导的过度凋亡可能是INH诱导的肝损伤发生的重要机制,特别是在DILI的早期。4-PBA是内质网应激的抑制剂。郭等对PZA作用下的内质网应激标记物GRP78、IRE-1α、XBP1s、ATF4、ATF6以及CHOP在HepG2细胞和大鼠肝脏中的mRNA表达进行测定,PCR结果显示,PZA处理的HepG2细胞中mRNA表达显著上调, PERK-eIF2α-ATF4-CHOP通路中蛋白质GRP78 、p-PERK、 p-eIF2α、ATF4和CHOP的表达也上调,提示PERK-eIF2α-ATF4-CHOP通路的激活可能是PZA诱导细胞凋亡的重要机制之一。在4-PBA作用下,PZA引起内质网应激相关蛋白表达下降,并且PZA诱导细胞凋亡的作用减弱,提示PZA通过降低4-PBA水平抑制PERK-eIF2α--ATF4-CHOP途径引起肝损伤。4-PBA通过抑制PERK-eIF2α-ATF4-CHOP途径也可减轻L02细胞中RFP诱导的损伤,提示RFP可能也是通过降低4-PBA水平抑制此途径引起肝损伤。
(四)免疫反应与肝损伤
INH、RFP、PZA在人体内可作为半抗原介导免疫反应而造成肝损伤。体外研究发现,INH通过自身氧化与HSA结合,在HSA中再与赖氨酸残基形成异烟酰胺加合物,这种共价复合物引起异质性免疫反应。体外实验表明,INH可以与巨噬细胞结合,刺激白介素-6的产生,从而启动免疫反应。有文献报道,RFP引起的过敏反应大都是由于抗利福平抗体(ARA)介导的免疫反应所致,主要参与的抗体包括IgM、IgG和IgE,可能的机制涉及I型、Ⅱ型、Ⅲ型和Iv型超敏反应。并且在接受INH、RFP和PZA联合治疗的结核病肝损伤患者中发现阳性淋巴细胞转化试验(LTTs)呈阳性,提示肝损伤是免疫介导的。张云等在PZA对斑马鱼幼鱼的肝脏毒性及其毒性机制研究中发现,炎症因子TNF-d和TGF-B显著升高,可见PZA诱导的肝损伤与免疫反应密切相关。总而言之INH、RFP、PZA可能激活了肝细胞中的特异性免疫信号通路,最后导致免疫反应和组织损伤。
(五)PPARα与肝损伤
PPARα为过氧化物酶体增殖物激活受体α,在肝脏中高表达, PPARα基因缺陷会增加肝脏的甘油三脂蓄积。张等将斑马鱼幼虫暴露于PZA 72h后测定基因表达变化,发现PZA可降低肝脏脂肪酸结合蛋白(L-FABP)及其靶基因过氧化物酶体增殖物激活受体α(PPAR-α)的表达,并通过上调炎性细胞因子引起更严重的氧化应激和肝炎,如肿瘤坏死因子α和转化生长因子β,表明PPAR-α介导肝脏脂肪酸结合蛋白的下调似乎可以引起斑马鱼幼虫肝细胞凋亡。
(六)基因多态性与肝损伤
药物代谢酶、药物转运体、抗氧化反应及免疫反应多种基因的多态性与INH、RFP、PZA诱导的DILI易感性有关。与其易感性相关的Ⅰ相药物代谢酶主要有细胞色素P450 2E1(CYP2E1)、CYP3A4、CYP2B6与丝氨酸酯酶(CES1);参与Ⅱ相代谢反应的酶主要是谷胱甘肽S转移酶(GST)和N-乙酰转移酶2(NAT2)等。同样免疫反应在 DILI 发生过程中发挥了重要作用。体内炎症-抗炎反应的失衡方向,决定肝细胞是发生损伤反应还是修复反应 ,而TNF-α、IL-4、IL-6和IL-10对炎症-抗炎平衡影响较大。
三、抗结核药物肝损伤的临床表现和分级
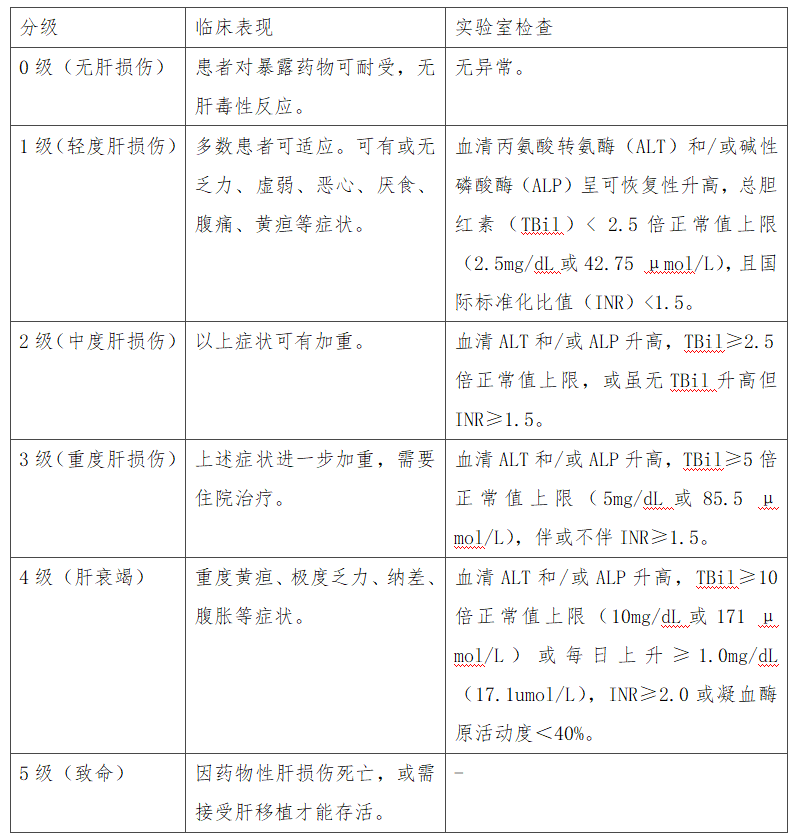
抗结核DILI发生时间与其他DILI发病规律相一致,大部分在初次用药后的5天至2个月内发生。临床表现各异且无特异性,大部分患者可有乏力、纳差、恶心等症状,血生化检查轻者表现为一过性转氨酶升高,重者可致暴发性肝衰竭,甚至危及生命。根据实验室检查和临床表现对DILI进行分级(表1)。
表1 DILI的临床分级
四、抗结核DILI临床处理原则
(一)停用导致肝损伤的可疑药物
首要原则是停用导致肝损伤的疑似药物(包括抗结核药物和其他辅助用药)。
(二)根据转氨酶异常程度处理
1.单纯转氨酶异常或轻度肝损伤,ALT<3倍正常值上限,无明显症状及黄疸者,在密切观察下加强保肝治疗,并酌情停用肝损伤的相关药物。
2.ALT≥3倍正常值上限,或TBil≥2倍正常值上限,应停用肝损伤相关药物,加强保肝治疗,密切观察。
3.ALT继续升高至超过5倍正常值上限,或ALT≥3倍正常值上限伴有相应症状,或TBil≥3倍正常值上限,应立即停用所有与肝损伤相关的药物,监测凝血功能,积极保肝治疗,严重肝损伤患者应采取综合治疗措施,一旦进展至肝功能衰竭,需积极采取抢救措施。
(三)合理使用保肝护肝药物
1.草苷酸类抗炎护肝药。具有类似糖皮质激素的非特异性抗炎作用而无免疫抑制功能的不良反应,具有保护肝细胞,改善肝功能的作用。
2.抗氧化类药物。抗脂质过氧化,抗纤维化,清除自由基,维持细胞膜稳定,促进肝细胞再生,可快速降低ALT。
3.缓解胆汁淤积的药物。可保护受损的胆管细胞,刺激胆汁分泌,激活疏水胆汁酸的解毒作用,抑制肝细胞凋亡。
4.保肝解毒药。保护肝脏线粒体结构,促进肝细胞再生,清除自由基。
5.肝细胞膜修复保护剂。促进再生肝细胞,并将中性脂肪和胆固醇转化成容易代谢的形式,降低脂肪浸润,协调磷脂和细胞膜的功能。
五、抗结核药物肝损伤的预防
(一) 早期识别发生肝损伤的高危人群。包括高龄、女性、酗酒、已有肝功能异常、合并其他病毒性肝炎、人类免疫缺陷性病毒(HIV)感染、营养不良等人群。
(二) 治疗前评估和检查。结核病患者治疗前需要详细询问既往用药史、患者的病情、进行肝脏生化指标、肝炎病毒血清标志物检查,必要时进行肝脏影像学检查,评价全身状况、相关危险因素和肝损伤程度等。
(三)高危人群抗结核药物的选用。少用或慎用肝损伤发生频率较高的抗结核药物,对高危人群给予预防性保肝治疗。
(四)监测肝脏生化学指标。患者治疗期间严密观察症状、定期复查肝功能,及时发现和避免发生严重肝功能损害。
(五)结核病合并HIV感染者,若无法耐受标准抗结核治疗方案,需要适当调整治疗方案,做到合理治疗。
(六)结核病合并病毒性肝炎的患者,如具有抗病毒治疗指征,则应尽快采用抗病毒治疗,根据其肝功能状况、病毒载量和病情,决定抗病毒和抗结核治疗的时序。
六、抗结核药物性肝损伤防控策略建议
(一)强化抗结核治疗期间肝损伤的监测和预警
加强抗结核治疗期间肝功能的监测,建立肝损伤预警机制,是预防重度、危重度肝损伤最有效的措施。肝损伤的监测包括症状监测(恶心、呕吐、厌油、肝区胀痛、皮肤及巩膜黄染等)和实验室监测两个方面。探索人工智能(AI)在肝损伤早期预警的作用。
(二)针对肝损伤的程度选择抗结核治疗方案
患者在抗结核治疗前肝功能各项指标正常者接受标准抗结核治疗方案治疗。如果一项或几项肝功能指标异常,应结合患者病情、机体状况,选择肝损伤不良反应发生率低的抗结核药品组成个体化的治疗方案进行治疗。老年人、肝损伤的高危人群,抗结核DILI发生率高,制定个体化的抗结核治疗方案。
(三)科学选用保肝药物
依据肝损伤不同级别和发生机制选择保肝治疗药物,科学选用抗结核药毒性削减治疗、降酶治疗以及免疫调节等治疗。开展药物性肝损伤多学科研究,探索肝损伤治疗新疗法,提升保肝治疗效果。
(四)研究肝损伤易感人群的标识
加强基础研究,筛选肝损伤的标识物,揭示肝损伤发生机理,预测发生相关药物不良反应的高危人群。
(五)强化抗结核药品质量管理
将抗结核药品纳入重大公共卫生产品管理,对在我国上市的抗结核药品,参照世界卫生组织质量预认证标准,定期进行专项质量检查。
(六)提高抗结核药品不良反应的处置能力
对结核病临床医生进行抗结核药品不良反应观察与处置的培训,提高抗结核药品常见不良反应诊断及处理能力。