问题分诊室
肿瘤免疫疗法新契机:如何看待缺氧条件下的T细胞免疫衰
发布时间: 2021-02-03
作者:Katherina
责编:兮
肿瘤和一些慢性传染病感染会诱发T细胞衰竭 (T cell exhaustion),然而对于此种免疫衰竭的诱因却知之甚少。尽管以前人们认为抗PD-1的免疫疗法可以阻断末端衰竭T细胞的PD-1信号转导,然后高肿瘤浸润性的衰竭性T细胞却对PD-1阻断剂疗法表现出很强的抗性。在缺氧环境中产生细胞代谢压力,缺氧诱导因子HIF-1α 及其负调控因子也会产生免疫抑制作用 【1,2】。然而,是否由于T细胞免疫衰竭诱发细胞代谢改变,还是代谢功能的缺失与代谢压力(metabolic stress)促使T细胞衰竭?
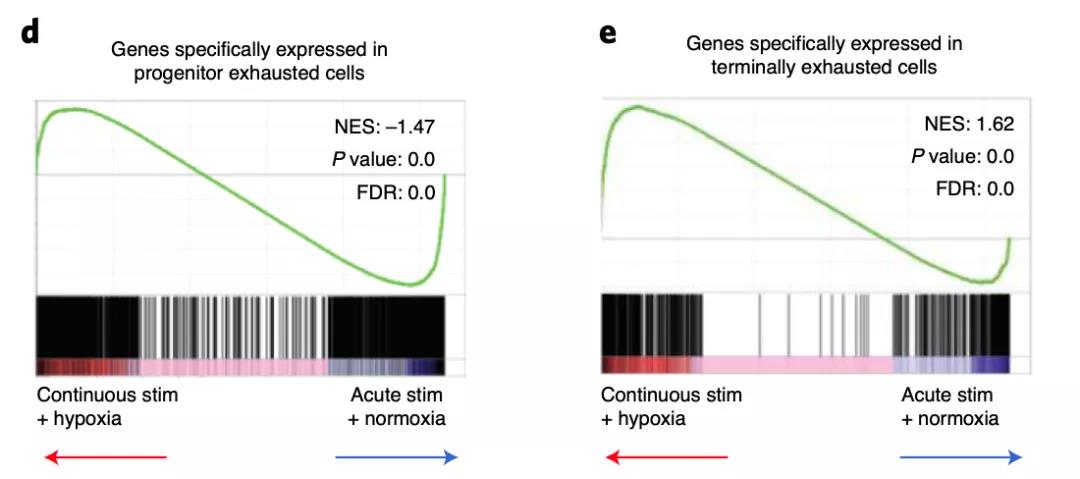
近日,美国匹兹堡大学Greg M. Delgoffe团队在Nature Immunology期刊发表题为”Mitochondrial stress induced by continuous stimulation under hypoxia rapidly drives T cell exhaustion”的研究论文。他们通过建立一种体外系统,模拟持续性抗原刺激T细胞和缺氧如何在T细胞免疫衰竭中发挥作用。他们发现,在缺氧情况下起源于线粒体的代谢压力反而可以加速细胞的终末分化,提高T细胞的活性氧(ROS)水平,造成严重的T细胞功能异常与衰竭。因此,降低T细胞内在的ROS和缓解肿瘤细胞的缺氧环境,便可以有效阻断T细胞免疫衰竭,达到与肿瘤免疫疗法的协同抗癌作用。

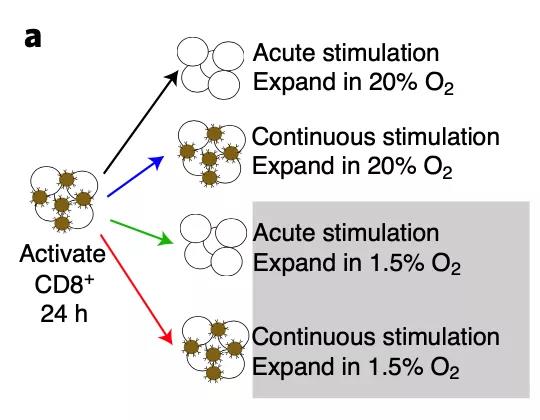
接下来,他们尝试研究是否缓解缺氧状态可以帮助T细胞免疫分化状态改变从而有利于肿瘤的免疫治疗。首先,低剂量的阿西替尼(一种酪氨酸激酶抑制剂)治疗B16荷瘤小鼠可以缓解总肿瘤环境和T细胞的缺氧情况。若同时给予这些B16荷瘤小鼠CTLA-4和PD-1阻断治疗,可以有效看到肿瘤的生长被抑制。而在肿瘤免疫治疗(例如美国FDA已经批准的肾细胞癌免疫疗法)中,VEGF(血管内皮生长因子)拮抗作用可能是使肿瘤浸润性T细胞免于代谢压力的关键因素。
原文链接
参考文献
1. Doedens, A. L. et al. Hypoxia-inducible factors enhance the effectorresponses of CD8 T cells to persistent antigen. Nat. Immunol. 14,1173–1182 (2013).
2. Gropper, Y. et al. Culturing CTLs under hypoxic conditions enhancestheir cytolysis and improves their anti-tumor function. Cell Rep. 20,2547–2555 (2017).

Copyright © 2022 中国科学技术协会 版权所有 | 京ICP备16016202号-20
Copyright © 2022 中国科学技术协会 版权所有 | 京ICP备16016202号-20