7月21日,生命学院朱斌教授团队在微生物领域顶级期刊《Cell Host & Microbe》发表题为Prokaryotic Gabija complex senses and executes nucleotide depletion and DNA cleavage for antiviral defense的研究论文。
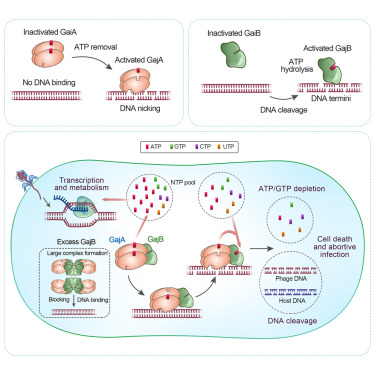
原核生物及其病毒之间的免疫与侵染是自然界最大规模的军备竞赛,也是生物技术的宝库。解析清楚的原核生物免疫机制如限制修饰系统和CRISPR系统分别带来了基因工程和基因编辑的技术革命。最近宏基因组生物信息学分析预测了大量潜在的未发掘原核生物免疫系统,其中一个是存在于15%已测序细菌和古菌基因组之中,在自然界丰度仅次于限制修饰系统和CRISPR系统的以守护女神命名的Gabija防御系统,仅由GajA和GajB两个基因组成,转入芽孢杆菌Gabija系统的大肠杆菌可以高效免疫各类烈性病毒的侵染。Gabija系统即使对非天然宿主也完全无毒副作用,这使得Gabija系统成为自然界最广谱高效且精简的免疫系统之一。
朱斌课题组基于长期的核酸代谢酶研究基础,首次对Gabija系统分子机制开展研究。课题组2021年报道GajA是一个受NTP浓度负调控的DNA缺刻酶,病毒侵入后高强度的转录降低了细菌细胞内NTP浓度,使GajA活性得以激活,对病毒和细菌自身DNA进行切割(Cheng et al., 2021,Nucleic Acids Research, doi: 10.1093/nar/gkab277)。然而仅有GajA无法完成抗病毒免疫,GajB也是Gabija的防御必须元件。本研究发现GajB是一个受DNA末端激活的A/GTP水解酶,其激活信号是具有一定长度DNA的3’末端。GajA和GajB的激活信号和反应效果恰好互补,这两个酶分别感知病毒的转录和DNA复制起始反应,并通过反应效果与激活信号的互补互相激活产生极联放大的正反馈循环,破坏细胞DNA同时清除重要代谢物A/GTP导致流产感染。GajA和GajB形成复合物以增强协同效果,但复合物中GajB的量必须低于GajA才能执行免疫,过量的GajB会导致形成巨大复合物影响GajA结合DNA。二者比例通过转录终止机制进行调控。两种前所未见酶活性的巧妙配合使Gabija免疫机制显著区别于已知免疫机制。限制修饰系统和CRISPR系统机制解析早期工作由欧美众多实验室完成,而Gabija免疫核心机制由朱斌课题组通过生化手段独立阐明。
论文链接:https://www.cell.com/cell-host-microbe/fulltext/S1931-3128(23)00265-2
DOI: https://doi.org/10.1016/j.chom.2023.06.014
(来源:华中科技大学新闻网)



 微信公众号
微信公众号
 下载app
下载app
 京公网安备 11010202008974号
京公网安备 11010202008974号