2022年10月29日,由中华中医药学会、人民卫生出版社、世界中医药学会联合会主办的《中成药上市后临床安全性研究指南》《中成药上市后临床有效性研究指南》《中成药上市后经济学评价指南》三项中华中医药学会团体标准发布会在京召开。中华中医药学会副会长杨明会、世界中医药学会联合会副主席兼秘书长桑滨生、人民卫生出版社总编辑杜贤、世界中医药学会联合会中药上市后研究与评价专委会会长谢雁鸣、中国医学科学院药用植物研究所教授孙晓波、中华中医药学会标准化办公室负责人苏祥飞,以及来自国内外1万余人通过线上线下同时参会。

《中成药上市后临床安全性研究指南》《中成药上市后临床有效性研究指南》《中成药上市后经济学评价指南》三项中华中医药学会团体标准为开展中成药上市后安全性研究、有效性研究、经济学评价提供了参考,有利于规范中成药安全性研究、有效性研究、经济学评价工作,提升中成药上市后相关研究与评价水平,助力中药产业高质量发展。
中华中医药学会团体标准发布目录
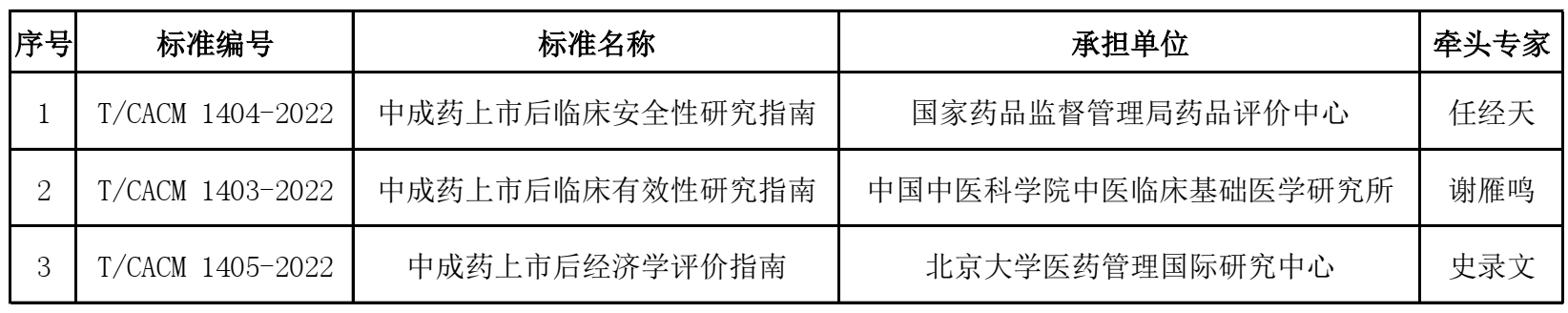
1.《中成药上市后临床安全性研究指南》(牵头人:任经天;承担单位:国家药品监督管理局药品评价中心)
中成药上市后临床安全性研究是中药药物警戒的重要内容。医疗科研机构、药品上市许可持有人、药品生产经营企业发起或开展、以临床安全性为主要研究目的、以上市后中成药为研究对象的医学研究,可以参考《中成药上市后临床安全性研究指南》。本指南提出规范开展研究的基本原则、选题决策要点,通过明确研究目标、细化研究问题、确定研究思路,在充分考虑研究合规性、科学性、伦理性以及可操作性基础上,选择适宜的研究方法。本指南充分应用现有研究成果,在研究设计、方案实施和总结报告环节围绕安全性要求,强调中医药特色,为中成药强推荐等级证据的产生提供了指导,为开展中成药上市后评价提供了基础。 (此部分内容由项目组提供)

2.《中成药上市后临床有效性研究指南》(牵头人:谢雁鸣;承担单位:中国中医科学院中医临床基础医学研究所)
本文件参照国际药品上市后研究的模式和理念,在我国相关法律法规和技术指导文件的框架下,充分考虑中成药自身特点以及我国国情,兼顾药品上市许可持有人、临床研究者、药品监管部门及药品使用者的多重视角,从研究决策、基本要求和分类研究三个层面指导中成药上市后有效性研究的开展。文件从研究的设计类型、研究对象、样本量确定、观察时点、疗效指标、偏倚、数据缺失和证据等级及适用性八个方面提出了研究的一般要求,从证候药及中药证候疗效评价研究、以临床价值为导向的效应机制研究、不同给药途径的中成药有效性研究三个方面阐释了分类研究要点,旨在为中成药上市后有效性研究提供通用的方法学指导。 (此部分内容由项目组提供)

3.《中成药上市后经济学评价指南》(牵头人:史录文;承担单位:北京大学)
传统中成药是我国重要的药品使用医疗资源,是我国医药费用支出的重要组成。但中成药上市后经济学评价较少,规范性差,评价质量参差不齐,不能有效支持医药卫生决策,总体水平有待提高。北京大学医药管理国际研究中心与中国中医医学研究院联合邀请全国范围内药物经济学、临床医学、药学、流行病学和循证医学等学科的专家研制和起草本文件,旨在为中成药上市后经济学评价提供通用的方法学指导,提高中成药经济学评价的规范性和研究结果的科学性,进而提高中成药上市后经济学评价的整体水平。
本文件起草遵循我国相关法律法规和技术指导文件的框架,基于中医理论指导,注重中成药自身特点。本文件从经济学评价基本原则、研究选题决策、研究问题界定、研究设计类型选择、成本识别与测量、健康产出类型、评价方法等方面,对中成药上市后经济学评价中常见问题和难点,针对性地提出了方法学建议和决策建议。 (此部分内容由项目组提供)

(来源:中华中医药学会)




 微信公众号
微信公众号
 下载app
下载app
 京公网安备 11010202008974号
京公网安备 11010202008974号