
摘 要
2020年,受益于医疗需求提升和进口替代政策的不断落地,国产医疗器械行业面临极大发展机遇。与此同时,2020年,中国生物材料学会积极落实中国科协“服务科技经济融合发展行动”,分别围绕成渝经济区、长三角经济区、中部地区、环渤海经济区开展医疗器械产业的科技经济融合服务。成渝地区作为学会的落脚点,作为我国西部地区发展水平最高、发展潜力较大的城镇化区域及实施长江经济带和一带一路战略的重要组成部分,是学会科技经济融合工作的重点扶持区域。
本文聚焦于成渝地区医疗器械产业,从多角度论述了影响该城市群行业发展的因素。本文主要分为两个部分:
(一)围绕成渝医疗器械行业发展水平和发展质量进行了深度分析,从科研院所、医疗临床、机构平台等诸多方面论述了成渝地区发展医疗器械产业的优势及保障,并针对地域发展不均衡的问题,由成渝地区与国内发展程度较高的城市之间的差距为切入点,对创新能力、产业规模、人才留用与引进方面进行深入分析。
(二)根据成渝地区经济社会发展需要,立足于全球视野上医疗器械产业发展趋势,通过对比、归纳等方法给出政策建议及发展策略,以期对成渝地区医疗器械产业促进方案提供参考。
关键词:医疗器械 成渝经济圈 政策建议 科技经济融合
一、成渝地区医疗器械产业发展情况
(一)发展现状
1、生产型企业
截至2019年底,成渝地区共有医疗器械生产企业672家,包含可生产I类产品的企业285家,可生产II类产品的企业468家,可生产III类产品的企业72家。其中成都、重庆分别以284家、280家的企业数量占据明显领先优势(见图1)。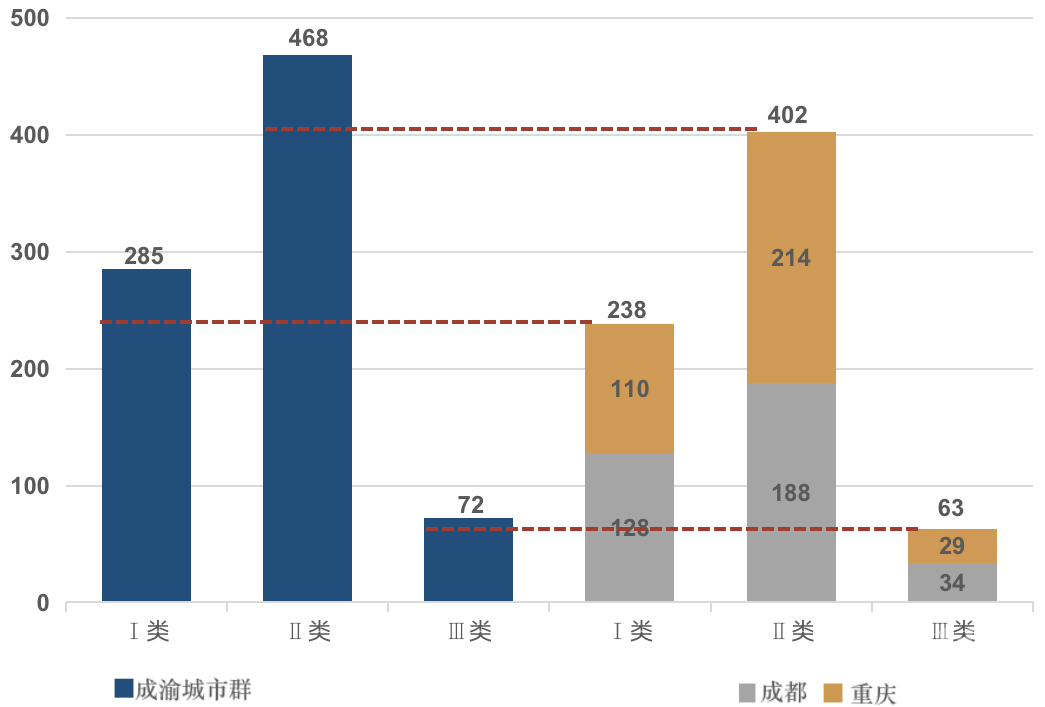
图1 成渝城市群(蓝色)医疗器械生产企业数目概况,其中绝大多数企业均汇集在成都(灰色)及重庆(黄色)两地
截至2019年底,医疗器械产品注册量共计4165件,同比增长20.20%。其中Ⅰ类产品1417件,占比34.02%;Ⅱ类产品2404件,占比57.72%;Ⅲ类产品344件,占比8.26%(见图2)。
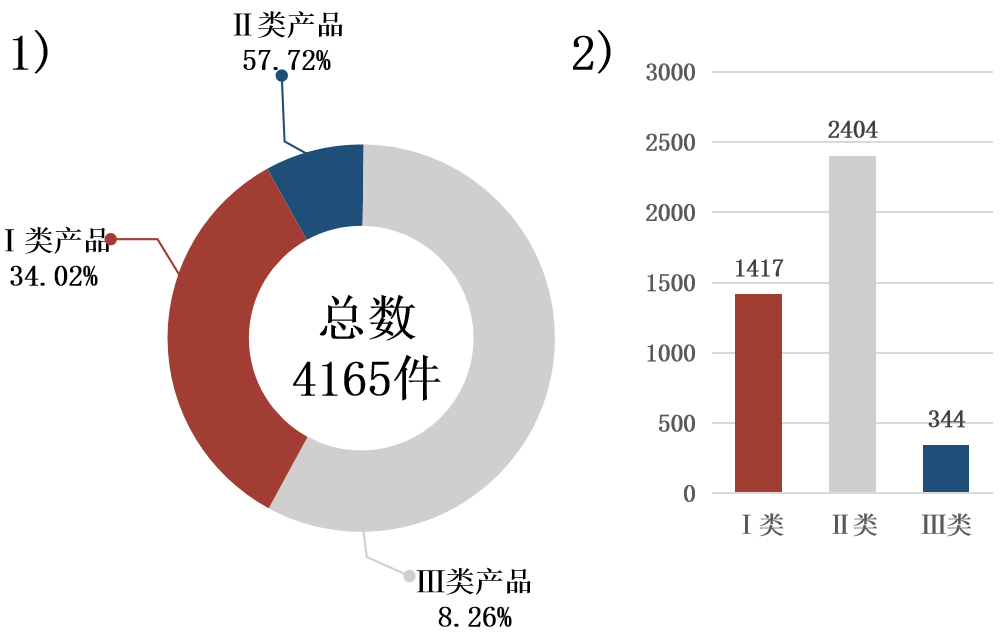
图2 成渝城市群医疗器械生产企业产品结构与数量
从细分市场看,成渝地区医疗器械产品主要为体外诊断试剂,注输、护理和防护器械,口腔科器械,物理治疗器械,医用成像器械,患者承载器械,临床检验器械以及骨科手术器械等(见图3)。
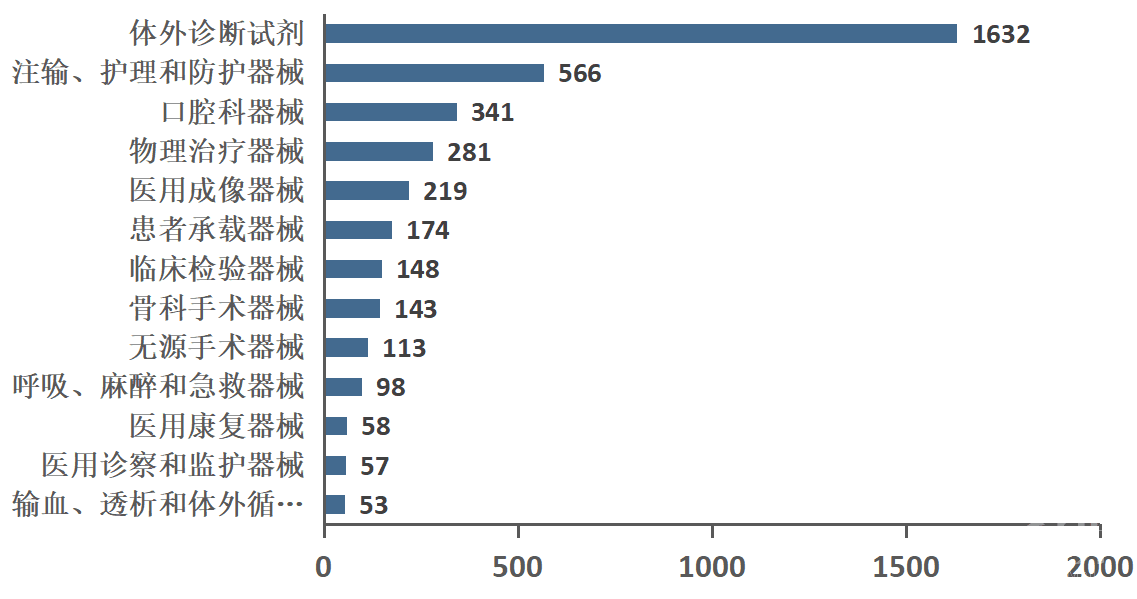
图3 成渝地区医疗器械产品细分领域数量分布,图片来源:众成医械大数据
2、经营型企业
截至2019年底,成渝地区共有II、III类医疗器械经营企业41243家。经营企业数量排名前三的城市分别为:重庆市10791家,成都市9272家,南充市2953家。其中,仅经营二类医疗器械产品的企业30869家,仅经营三类医疗器械产品的企业5422家,同时经营二、三类医疗器械产品的企业4952家(见图4)。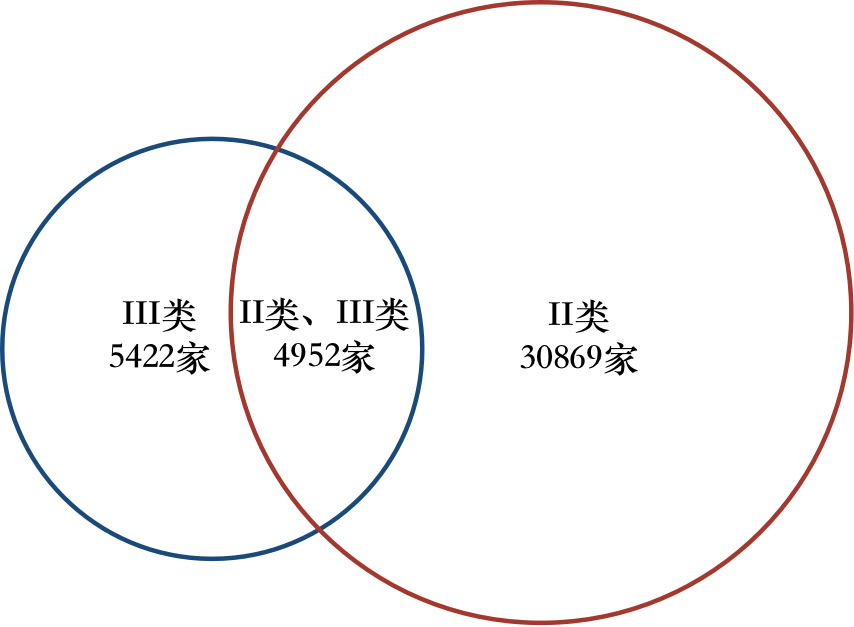
图4 成渝城市群医疗器械企业经营类型及数目
3、企业创新能力
截至2019年底,成渝地区实有医疗器械高新技术企业147家。数量排名前三的是:重庆市78家,成都市60家,绵阳市2家(见图5)。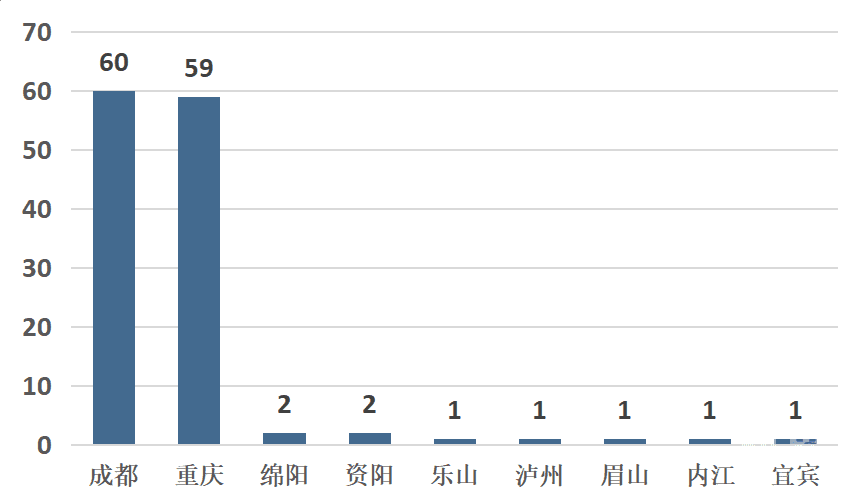
图5 成渝地区高新技术企业数量分布
截至2019年,成渝地区实有科技型中小企业69家,同比减少9家。数量排名前三的是:成都市41家,重庆市15家,绵阳市3家(见图6)。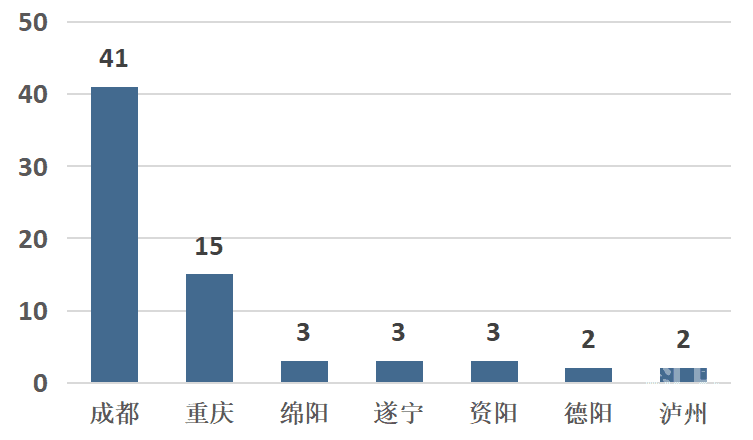
图6 成渝城市群科技型中小企业数量分布
依托成都、重庆两地丰富的科研资源和研发机构,成渝地区医疗器械产业领域发明专利和文献等知识产权成果较为丰富,截止2019年底,成渝地区医疗器械企业专利授权累计5798项。从专利类型来看,实用新型专利占66.83%,发明授权占15.73%,外观设计占17.44%(见图7)。2017-2019年期间,成渝地区医疗器械企业专利授权数量年均保持37.31%的增速,三年平均年数量为1021件。
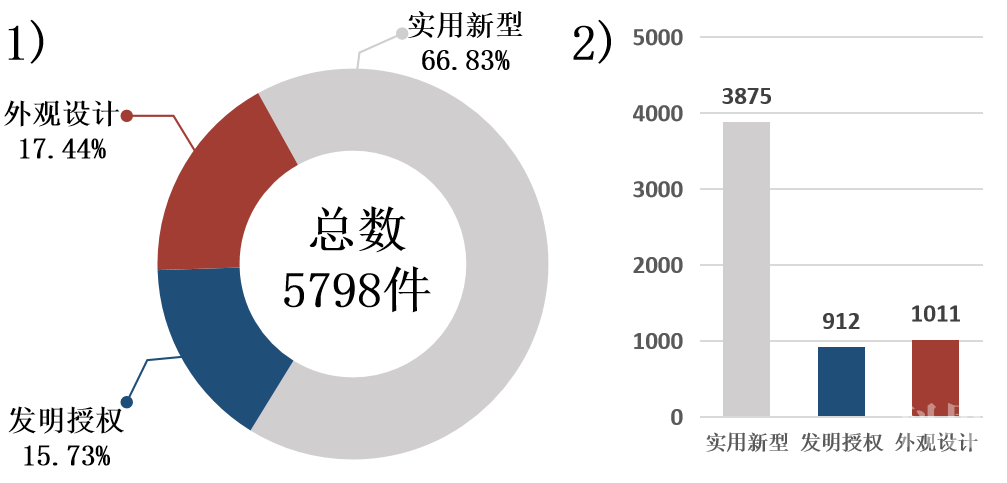
图7 成渝城市群企业专利授权类型占比
(二)发展资源和优势
1、机构资源优势
医疗机构:成渝两地的优质医疗资源为发展高端医疗器械提供了广阔的销售市场及优良的技术保障。截至2019年底,成渝地区实有三甲医院135家,这其中包括两家国内顶级医院——四川大学华西医院和重庆医科大学附属第一医院。四川大学华西医院在综合排名方面连续十一年排名全国第二,其中科研连续十一年得分满分排名首位(复旦大学医院管理研究所发布)。重庆医科大学附属第一医院作为全国首批“三级甲等医院”,是融医疗、教学、科研、预防、保健及涉外医疗为一体的重点大型综合性教学医院。
动物试验机构:截至2019年底,成渝地区具备开展动物试验资质的企业或机构156家,具有动物试验生产资质的企业或机构34家。动物实验是评价医疗器械安全性和有效性的重要方式之一,能为产品设计定型提供相应的证据支持,为医疗器械能否进入临床研究阶段提供依据,是医疗器械产品走进市场的一张重要资格证。
医疗器械检验机构:截至2019年底,成渝地区实有医疗器械临床试验机构10家,分布在重庆市(3家)和成都市(7家)。根据《医疗器械监督管理条例》,医疗器械检验机构是第Ⅱ类、第Ⅲ类医疗器械产品注册申请资料中,提供产品检验报告的唯一指定机构,而产品检验报告则是医疗器械产品通往市场的通行证。
2、丰富的人才和高校资源
医疗器械行业作为知识和高端人才密集型行业,合格专业的人才队伍是影响企业发展的重要因素,大规模高素质的医疗器械研发专业人才是医械企业的核心竞争力,是企业前期战略布局考虑的一个关键因素,因此人才资源和高校资源就成为医疗器械企业选址的主要关注因素。成渝地区高校云集,拥有众多高校资源。2020年5月,成渝地区双城经济圈高校联盟在成都发起成立,四川大学、电子科技大学、重庆大学、西南大学等成渝地区20所高校加入。这些高校每年培养输出大批优秀的生物、医药、材料、机械、化工、电子信息等领域的专业人才,为成渝地区的医疗器械产业快速发展贡献关键力量。
此外,成渝地区还拥有一个特色资源——中国生物材料学会。中国生物材料学会是全国200余家学会中与医疗器械产业关系最紧密的学会之一,汇聚了全国生物材料研究领域和医疗器械产业领域的优秀人才。同时,中国生物材料学会是成渝地区唯一一家国家级学会,可直接、便捷地为成渝地区医疗器械产业提供学术交流、智库咨询、专业培训等服务。
3、产业基础优势
近年来,成渝地区逐步打造医疗器械聚集生产的主题园区,其中具有代表性园区有:合川工业园、川大牙科产业园、重庆大地企业公园等。医疗器械产业园作为各类医疗器械企业经营发展的重要载体,不仅提高了地区产业的集中度,而且更利于械企的相互竞争相互学习,极具专业性和领先示范作用。近年来,各地通过建立医疗器械主题园区,进一步促进医疗器械产业集中化与规模化,为医疗器械产业发展打造了更为坚实的基础。成渝地区医疗器械产业园及生产企业数量请见图8。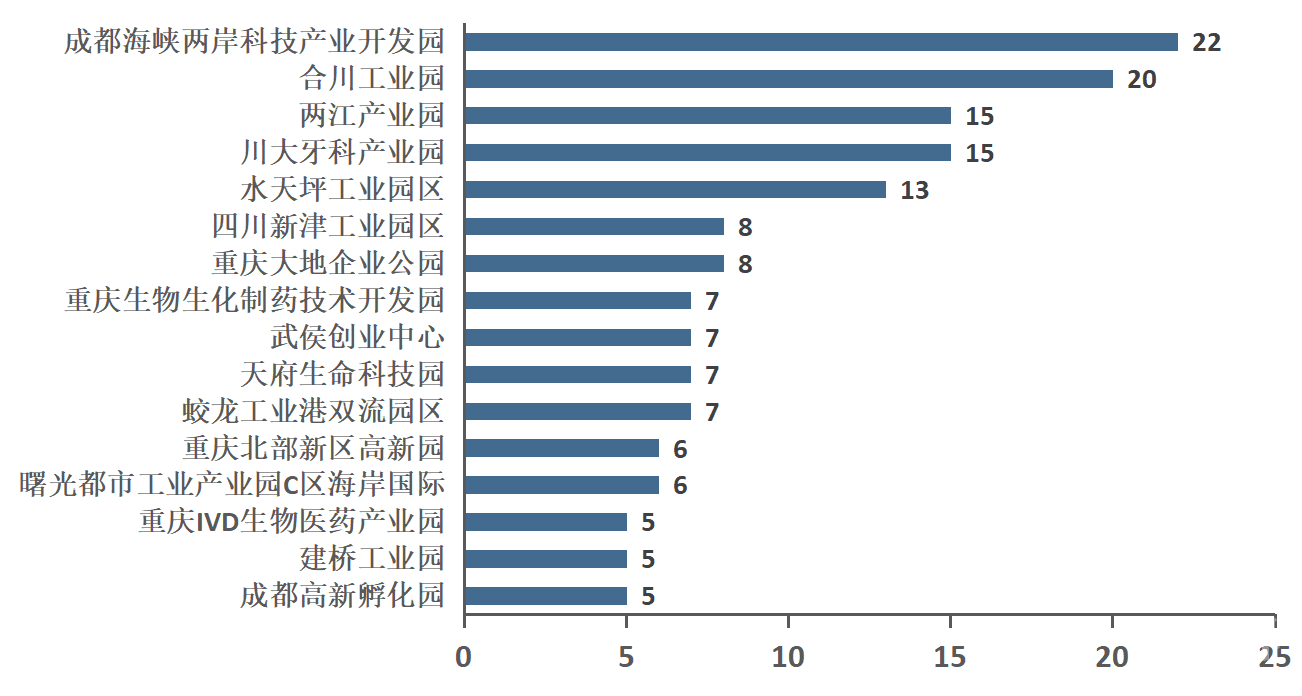
图8 成渝地区医疗器械产业园及生产企业数量,图片来源:众成医械大数据
(三)面临的困境和问题
1、相较国内发达地区差距明显
2019年,我国各省(市)获批II、III类医疗器械数量,江苏、北京、广东依次位居前三位,均超过千件。然而,重庆市以384件排全国第八,四川省以207件排第十三位,差距明显(见图9)。
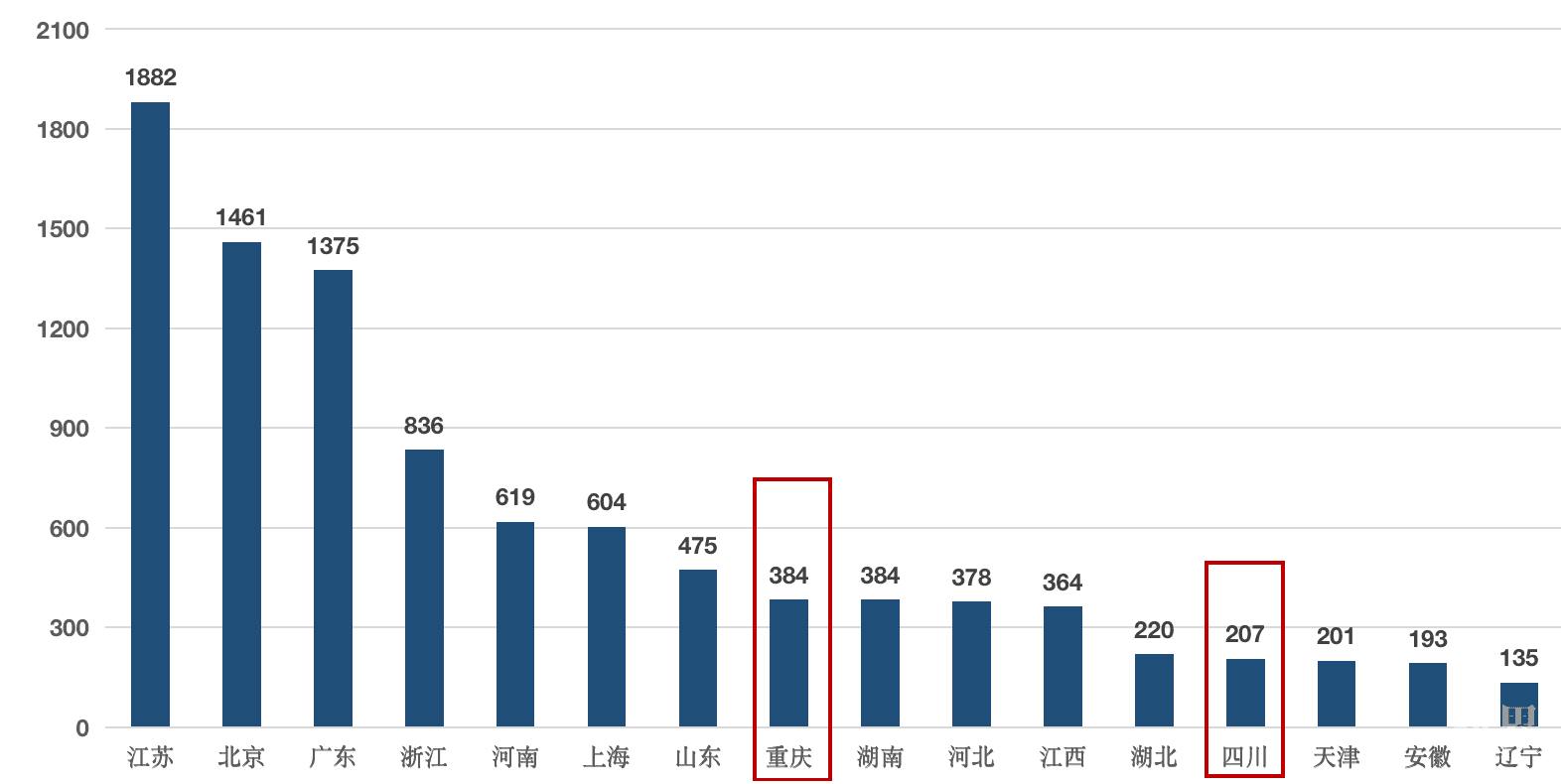
图9 我国获批II、III类医疗器械省(市)分布
在III类医疗器械获批方面,北京、江苏、广东、上海依次位居前4名,均超过百件,遥遥领先四川省和重庆市(见图10)。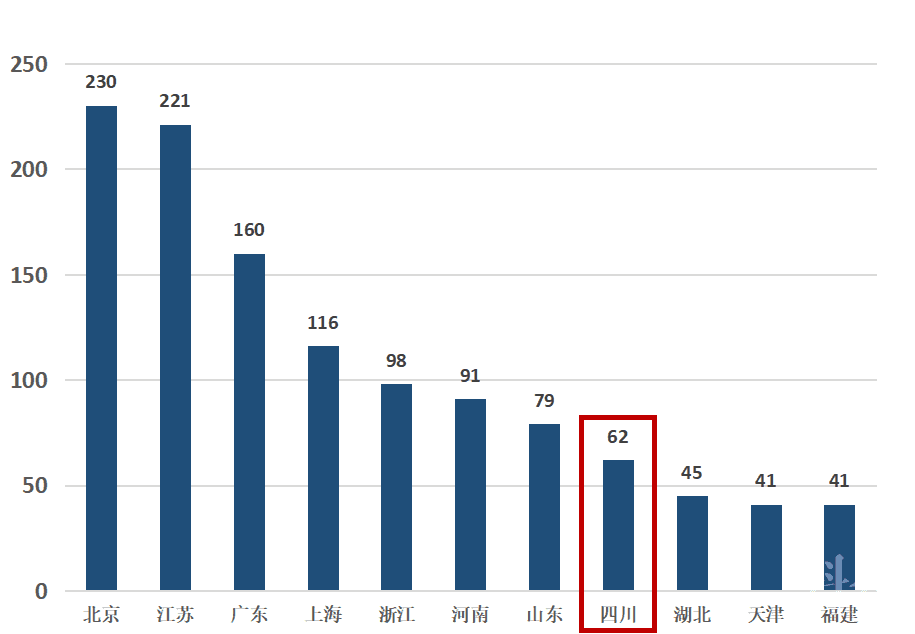
图10 我国获批III类医疗器械省(市)数量分布
在创新医疗器械特别审批方面,广东、北京、浙江、上海依次位居前4名,成渝地区与上述地区相比,差距明显(见图11)。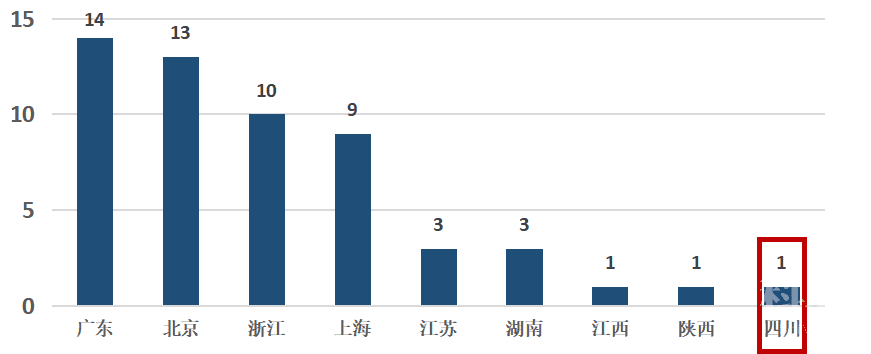
图11 我国创新医疗器械特别审批省(市)分布
2、科研投入不足,企业创新能力较弱
从成渝地区近些年来医疗器械整体生产情况来看,Ⅰ、Ⅱ类产品的生产数量远高于Ⅲ类产品。这说明目前成渝地区医疗器械产业主要以中低档医疗器械产品为主,且集中在技术低、投资少、回报周期短的医疗器械上,在高端医疗器械的开发方面仍存在困难。据了解,成渝地区生产型企业占比90%以上,研发型企业少,原创技术与原创产品较少。此外,虽然成渝地区总专利数量增加较快,但核心专利数量较少,产品研发水平相对较低。
3、中小型企业占比多,产业规模化程度不高
成渝医疗器械生产企业数量众多,普遍规模不大,存在着多、小、散现象。截至2019年底,在成渝地区近700家医疗器械生产企业中,上市企业仅10家,占比不到1.5%,缺乏具有领军气质的企业。在成渝医疗器械行业中占主体的中小企业,绝大多数是劳动密集型企业或简单的易耗性医疗用品生产企业,产品的同质化现象和规模不经济现象严重,存在低水平重复和市场竞争水平提高不快、产业技术和人才集群度偏低等问题。与国内医疗器械产业发展迅猛的深圳、江苏、上海等省市相比,呈现差距逐渐拉大趋势。
4、人才短缺且流失严重
成渝地区地处西部地区,受北京、上海、广州、深圳超一线城市的高薪和高生活质量的冲击,难以留住高层次专业人才,特别是能够指导和帮助企业提升自主创新能力,解决产业、企业技术难题的高端专家和专业技术人才,在科研人才、管理人才的留用、引进上面临着较大的困难。“同等待遇引不来,太高待遇引不起”是成渝地区大部分企业所面临的客观现实。
四、政策建议
(一)最大化释放政策红利
1、深入推广医疗器械注册人制度
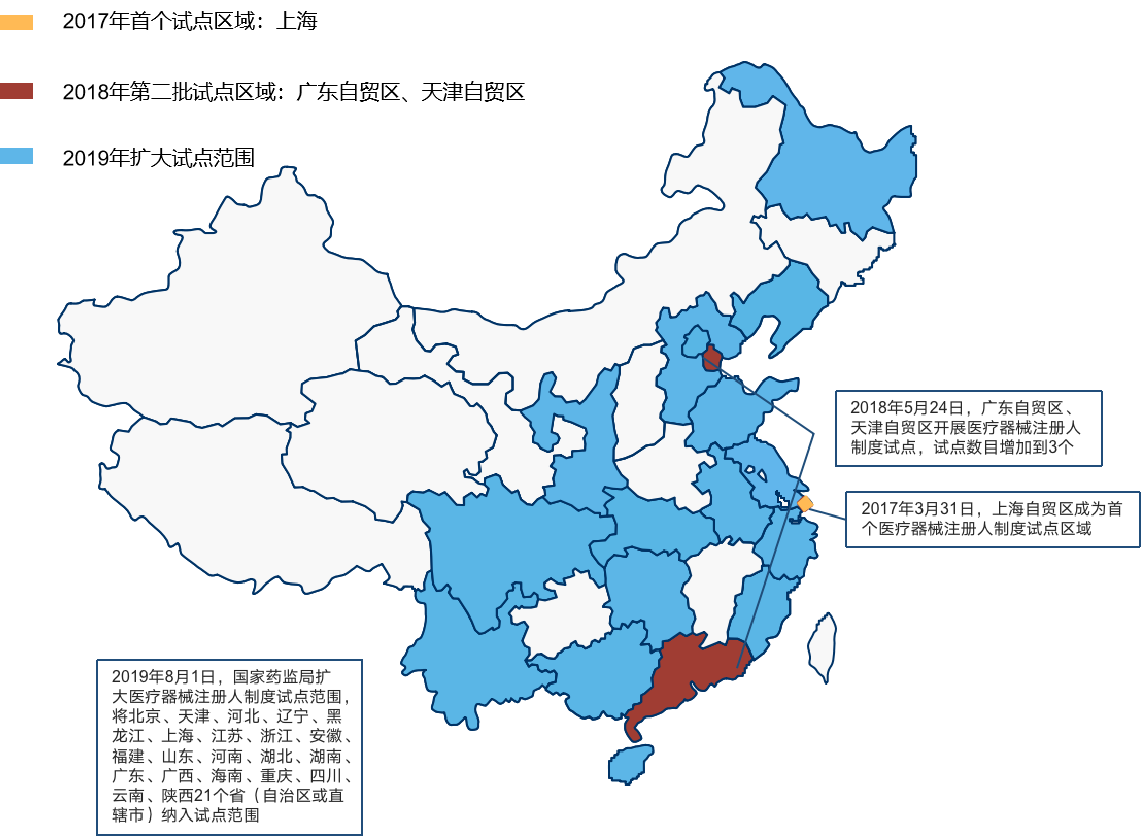
2019年,为加快推进医疗器械产业创新发展,进一步积累实施医疗器械注册人制度经验,在上海、广东、天津自贸区开展医疗器械注册人制度试点工作的基础上,国家药品监督管理局决定进一步扩大医疗器械注册人制度试点工作,四川和重庆被纳入试点范围(见图12)。
随后,两地陆续出台《四川省医疗器械注册人制度试点工作实施方案》(川药监发〔2019〕127号)和《重庆市医疗器械注册人制度试点工作实施方案》。医疗器械注册人制度是“推动医疗器械产业加速成长的颠覆性变革”,通过“解绑”生产方和技术方,使得医疗器械上市许可持有人不用再背负生产设备、人员、场地等资产运营压力,使其专注于产品研发,有利于激发医疗器械创新人才的积极性,同时将生产委托给有资质和生产能力的企业完成,这种分工能有效抑制医疗器械行业的低水平重复建设,也将加快创新产品的上市和落地。据统计,自开展试点工作以来,重庆市已有146个医疗器械产品按注册人制度获批,这一喜人的数据足以说明注册人制度在成渝地区是充满生命力的。 建议进一步加快注册人制度在成渝地区的落地速度,加大宣传推广力度,强化监督落实,鼓励相关企业积极参与进来,追赶上先行省市的速度。
图12 医疗器械注册人制度试点范围扩张路径图
2、减税降费、资金补贴等产业政策要落到实处
深入贯彻落实国务院减税降费政策,建议设立医疗器械产业扶持专项资金,分配给成渝地区各市(县)发改委、科技厅、卫健委、药监局等部门,使其分别在各自领域补贴医疗器械行业内相关企业与科研单位。同时建议相关部门在本地企业市场推广方面给予政策支持。例如,成渝地区医院医疗器械采购时可加大地区内部产品的采购比重。
(二)统筹谋划产业发展模式
1、并购整合是加速创新的有效手段
成渝地区医疗器械企业的现实困境可概括为:1.整个行业的基础门槛偏低;2.大多数企业的龙头产品的市场潜力并不大,单一产品的发展空间有限。与药品十年以上的产品周期不同,医疗器械技术更迭快,产品周期短,且新产品的推出往往会对过往产品产生颠覆性影响,因此对前沿技术的掌握极大影响着未来的市场格局。并购整合不仅能够降低研发风险、迅速扩大产品线,也能突破细分赛道天花板效应。全球顶尖的医疗器械企业都有着丰富的并购史,如美敦力通过执行多元化战略,在经历了数次并购后,由起搏器制造商最终成长为全球医疗器械巨头(见图13)。
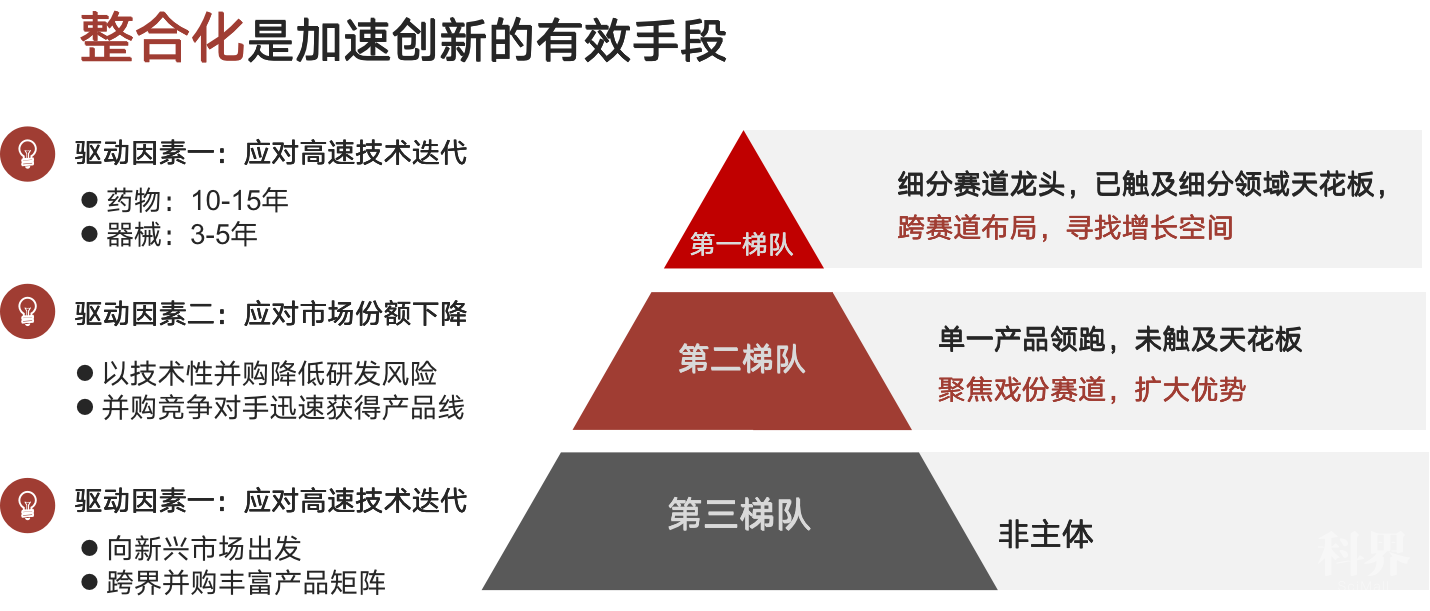
图13 整合化是加速创新的有效手段
2、培养龙头企业,发挥“头雁效应”
在医械行业,具备先发优势的行业领头雁,通常都具备极高的行业敏锐度,这类企业往往能有效发挥示范引领和促进产业链聚集等作用,在带动区域产业发展的进程中有着不可替代的重要性。
以位于山东省威海市的威高集团为例。2019年,山东半岛城市群乃至山东省医疗器械上市企业总营收约合278.7亿元,其中山东威高营收约合103.6亿元,全省占比37.17%,为全省最大医药企业,也是全球品种齐全、安全可靠、值得信赖得医疗系统整体解决方案制造商。多年来,威高在自身不断发展壮大的同时,积极发挥“头雁效应”,通过实现产业聚集发展、不断扩大规模效应、全面促进技术创新体系的建设和核心竞争力的提升,带动威海市乃至全山东省医疗器械产业上升到新的更高水平,将整个环渤海经济圈打造成为抢占世界医疗器械高技术产业制高点的前沿阵地。威高对威海市的医疗行业优势资源进行集中,整合上下游产业链,带动整个医疗器械产业升级,降低了威海市及周边地区医疗器械行业的市场竞争风险,实现了行业人才、技术、设备、信息的高度集中,达到了技术、经济、人才的良性循环和健康发展,带动了周边企业的大发展。
下一步,建议成渝地区多渠道集聚和培育一批具有引领性的领军企业。鼓励外资企业及其上、下游产业链企业来成渝地区发展,支持外资企业引入创新医疗器械。抓住成渝地区双城经济圈建设的大好时机,积极改善营商环境,重点引进北京、上海、广东、深圳等地的国内高科技医疗器械企业来成渝地区发展。
3、科学布局产业集群,彰显“聚集效应”
长三角城市群是我国医疗器械三大产业群之一,部分产业已呈现聚集态势,如浙江桐庐拥有全国最大硬管内窥镜生产基地、苏州的眼科设备、无锡的医用超声、南京的有源器械、宁波的磁共振等。成渝地区作为后起之秀,现已初步形成以先进制造业与战略性新兴产业为主体的产业结构,已集聚了信息通信技术及科研产业集群,在夯实基础的同时,大力发展生物医药产业。近年来,成渝地区各地通过建立医疗器械主题园区,进一步促进医疗器械产业集中化与规模化发展,为医疗器械产业发展打造了更为坚实的基础,其中代表性园区有:合川工业园、川大牙科产业园、重庆大地企业公园等。下一步,建议依托成都、重庆的科研资源优势和高新技术产业基础,充分发挥两江新区、天府新区高端要素集聚平台作用,巩固重庆合川产业园和成都高新技术开发区生物医药产业发展的同时,瞄准全球和国家科技创新趋势,共建川渝合作高新技术产业园,积极承接产业转移,重点布局生物医药产业。围绕 “鼓励创新” “推动高质量发展”两条主线,以“增加优质品种、提升制造能力、补齐平台短板、优化产业布局”为抓手,做强做优整个地区的生物医药产业。同时,积极参与全球生物医药产业分工,通过融合发展、协同发展等,全面提升人才和研发水平。
4、培育引进外包服务企业和平台
随着医疗器械注册人制度的落地推广,行业的研发、生产格局均将逐渐被改变,专业的研发型企业和机构以及专业的代工生产企业已经涌现,外包将成为不可逆转的行业发展趋势。2019年,全国医疗器械研发外包服务行业市场规模达100亿元,未来年均复合增速将超过20%,医疗器械研发外包服务行业一片蓝海(见图14)。
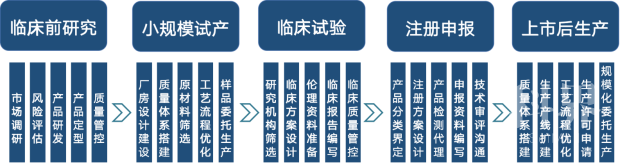
图14 医疗器械研发外包各环节主要服务内容
医疗器械研发外包服务企业包括医疗器械CRO(合同研究组织)与医疗器械CDMO(合同研发生产组织)两类。医疗器械研发外包服务经过前期发展,已经成为医疗器械研发主体降低前期投入、加快注册申报进程、减少产品上市风险的重要战略选择。数据显示,成渝地区CRO数量与长三角、珠三角、长江中游、京津冀等地区相比明显落后,而CDMO机构的数量为0(见图15)。下一步,建议把握市场需求,吸引更多外包企业入局,帮助成渝医疗器械研发主体在降低生产成本的同时提高生产效率。
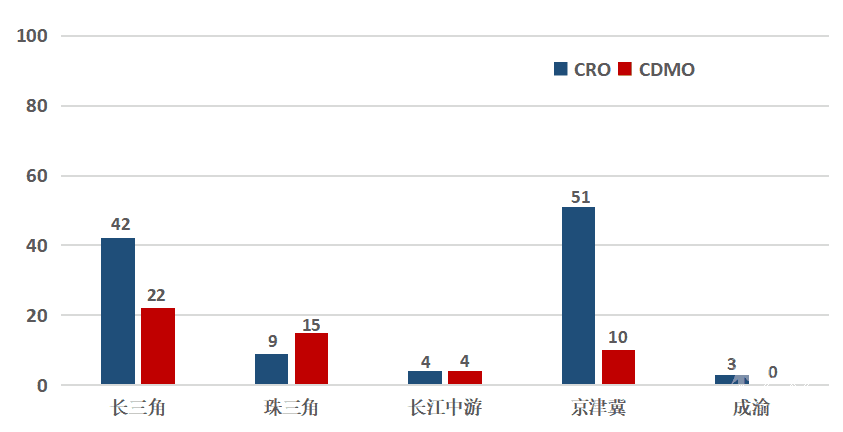
图15 不同城市群CRO/CDMO数目
5、加快推进本土化进程
国家出台了系列政策鼓励创新、鼓励使用本土产品,其核心一是通过特别审批和优先审批加快创新医疗器械审评审批速度,二是重点发展具有重要临床价值的产品,三是推动实现关键技术的自主可控,提高核心竞争力。在部分领域,如血管支架,已取得了较大成效,基本完成了本土化进程,国产品牌占据80%市场,且四代支架的研发水平已达全球领先(见图16)。又如直接数字平板X线成像系统DR,其核心部件X线球管、高压发生器、探测器等均已实现本土化零的突破。建议成渝地区在系列鼓励创新政策及科创板的推动下,为医疗器械的本土化做出更多贡献。
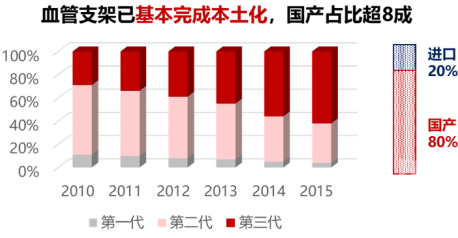
图16 血管支架国产占比超8成
6、突出优势/原创材料
骨科和心血管均为全球行业规模最大、集中度最高、附加值最高、成长速度较快的两大器械领域。Global Market Insights预计,全球骨科耗材市场2016-2024年CAGR约为3%。目前,全球常用的骨科植入材料主要有:不锈钢、钻合金、钛合金、氧化铝、氧化锆、磷酸钙盐、高分子量聚乙烯和碳质材料等,例如施乐辉(Smith&Nephew)的专利材料高交联聚乙烯(cross-linkedpolyethylene),捷迈(ZimmerBiomet)的骨小梁金属,史塞克(Stryker)的氮化钛表面材料,DepuySynthes的MARATHON交联聚乙烯和ALTRX-A交联聚乙烯等等。
相对于这种非组织诱导骨材料来说,四川大学张兴栋院士所研发的生物活性陶瓷,可在不外加骨生长因子或活体细胞的情况下,诱导骨的形成。这项研究促使了张兴栋和他的团队开发出了世界上第一个合成骨修复产品——骨诱导人工骨,该产品已获得了商业化的监管批准并获得全世界所认同。截至目前,30多万例病人使用了张兴栋团队研发生产的骨诱导材料,全国80%以上的人造关节都在使用他发明的材料涂层技术。成渝城市群应充分利用高校科研优势,推动诸如骨诱导人工骨的创新材料转化落地,为促进相关类型医疗器械领先国际水平助力。
7、多管齐下打造闭环生态
其发展逻辑为依托核心优势深耕器械赛道,再以器械为基础外沿拓展关联领域疾病用药,同时依托设备和药物提供一体化服务,最终形成闭环生态。以心血管龙头企业乐普医疗为例,公司围绕其核心产品冠脉支架,积极研发可降解支架、封堵器、起搏器等系列创新产品,同时依托原有赛道,布局硫酸氢氯吡格雷、阿托伐他汀等心血管系统用药,辅以第三方检验和血管专科医院,打造“器械+药物+服务”心血管健康全生态平台”(见图17)。

图17 乐普医疗打造闭环生态示意图
(三)深化产学研结合
产学研结合是我国科技体制改革的重要内容,产学研结合有助于解决科技与经济“两张皮”问题,促进科技经济融合发展。我国医疗器械行业长期探索实践产学研结合多种模式,贡献了以下案例可供成渝地区参考借鉴。
1、成果转让模式。高校、科研院所通过签订技术转让合同,将新技术、新产品、新工艺等专利权、专利申请权、专利实施许可权等科技成果有偿转让给企业,帮助企业将技术投入生产,形成生产能力。四川大学生物医学工程学院赵长生教授团队拥有专利:一种三元共聚物共混改性聚醚砜中空纤维膜及其制备方法和用途(专利号:201010134292.X),并于2012年4月18日将此项专利使用权转让给成都欧赛医疗器械有限公司。专利转让后,血液透析器产品出口印度、越南等16个国家,销售全国23个省、自治区、直辖市,包括成都军区总医院、厦门大学附属成功医院、华西医院等467家医院,近三年销售量超811万支,经济效益13.1亿元人民币。此类产品国产化后,国外产品价格大幅下降,每年为国家和患者减轻负担84.3亿元人民币。
2、合作开发模式。产学研各方共同投入一定的要素进行合作,共同就某一项目开展科研攻关,也可以是企业以项目方式将所需技术委托给高校或科研院所进行研究开发。中国科学院上海硅酸盐研究所慈溪生物材料表面工程中心是中国科学院上海硅酸盐研究所和中国科学院慈溪应用技术研究与产业化中心共同在慈溪设立的专业技术研究平台。目前,中心与当地企业浙江广慈医疗器械有限公司建立联合实验室,共同开展包括聚醚醚酮椎间融合器和肌腱锚合修复系统等新型医疗器械的表面处理技术开发,推动企业现有产品的转型和升级;为宁波慈北医疗器械有限公司研发钛基颅颌面修复系统表面处理技术,应用相关技术的内固定钛板和钛合金螺钉产品也分别获得医疗器械注册证。
3、资源共享模式。企业与科技资源相对充足的高校、科研院所进行合作,充分利用高校、科研院所的科技文献、仪器设备等资源,以解决自身科技资源不足的瓶颈问题。高校、科研院所也可能需要利用相关企业的厂房、加工设备等作为中试或实习基地。位于四川大学的国家生物医学材料工程技术研究中心是我国第一个开放性国家级生物医学材料专业研发机构,实验室与四川省肿瘤医院、四川大学华西医院展开了资源融合共享模式,依托实验室的实验设备以及人才资源,医院进一步将初步设想以科学实验的方式落到实处,或者依托实验室的研发力量合成出目标材料;而医院所拥有的丰富资源,也为实验室所研发的如超顺磁氧化铁、PET探针、MRI探针等材料创造了临床测试环境。这种共享方式将科研、临床经验与实验设备资源有机结合,为双方节省了大量资金与时间。
4、共建实体模式。企业与高校或科研院所组建公司、研究开发中心、中试基地等实体,成为相对独立的活动单位或法人。位于四川大学的国家生物医学材料工程技术研究中心与四川大学所属企业原四川大学生物材料工程研究中心合作成立四川拜阿蒙生物活性材料有限责任公司。公司已开发了磷酸钙陶瓷及涂层系列产品,目前正致力于研发软骨诱导性胶原水凝胶和3D增材制造组织诱导性产品。公司于2001年首次取得医疗器械生产企业许可证,2007年首批通过医疗器械生产企业质量管理体系规范试点检查,2016年通过ISO9001和ISO13485质量管理体系认证。
5、战略联盟模式。企业、高校及科研院所从各自的发展战略目标与战略意图出发,以股权或契约的方式建立的较为稳固的、长期的合作关系。四川大学华西医院专利申请和授权数在全国医疗机构中连续10年排名第一,近5年转让创新药物60余项,带动100多亿投资,麻醉新药专利数占全国总数20%……拥有科技成果转移转化的强大优势,2018年,华西医院制定出台《促进科技成果转移转化实施方案(试行)》,规定:允许成果完成人与医院事先协议约定职务科技成果的权属或股权比例;成果完成人可在申请专利或专利技术成果作价投资前与医院以协议的方式事先约定科技成果的权属或股权比例,并允许成果完成人以个人名义占有股份。同时,提出了原创成果通过转让或许可取得的净收入,以及作价投资获得的股份或出资比例,提取80-90%的比例用于奖励。
6、公共服务平台模式。政府或者公共服务机构通过线上资源对接,建立面向行业的公共服务平台,为企业提供专业的共性技术服务。2020年,由中国科协主办的“科创中国”科技经济融合线上平台正式上线,平台积极发挥科学家品牌、多学科综合交叉、央地无缝对接、国际组织联系等优势,旨在打通堵点、连接断点,引导技术、人才、数据等创新要素流向企业、地方和生产一线,加快促进科技向现实生产力转化。该平台主动服务具有创新需求的重点区域、重点产业和科技型企业,联结高校、院所、新型研究机构及科学家团队,实现供需对接,推动技术交易规范化、市场化,让科技更好服务经济社会发展。
7、人才培养模式。高校、科研院所与企业合作培养人才,在企业设立科研院所学生实习基地或博士后创新实践基地等。2002年3月,威高集团设立了博士后科研工作站分站,相继与中国科学院长春应用化学研究所、中国科学院沈阳金属研究所、哈尔滨工业大学、山东大学等签订了联合招收培养博士后的协议。经过十几年的运作,工作站先后引进了10名博士后研究人员进站,现在站2名,工作站在运行期间研发出的项目获得了国家科技进步二等奖及国家技术发明二等奖,申请发明专利24篇,发表论文20余篇,为企业发展增添了创新活力。
(四)提高行业监管水平
1、探索建立监管科学理论体系。医疗器械最根本的要求,就是保证产品的安全性和有效性。全球所有国家对于医疗器械的上市与使用都有严格的审评审批制度。医疗器械监管科学是医疗器械科学研究的基础,在保障人民健康方面具有重要意义。2019年4月,四川大学医疗器械监管科学研究院成立,是国家药品监督管理局首个医疗器械监管科学研究基地,致力打造全球享有盛誉的医疗器械监管科学研究中心。该研究院在国家药监局相关司局和四川大学的大力支持下,建立了以青年科研人员为主的国际化研究团队,通过与四川大学国家生物医学材料工程技术研究中心合作,具备了完整的医疗器械安全性和有效性评价试验条件,参与了国家药监局药品监管科学行动计划中的多个专项工作,承担了国家药监局医疗器械监管科学研究规划、亚太经合组织(APEC)监管科学卓越中心试点培训、国家药监局医疗器械GCP轮训等多项工作。建议成渝地区在监管科学方面加大鼓舞力度,逐步构建起监管科学理论研究和学术交流体系。
2、加快推进医疗器械唯一标识系统试点。医疗器械唯一标识(Unique Device Identification,简称UDI)是医疗器械的“身份证”,唯一标识数据载体是储存或者传输医疗器械唯一标识的媒介,唯一标识数据库是储存医疗器械唯一标识的产品标识与关联信息的数据库,三者共同组成医疗器械唯一标识系统。医疗器械唯一标识包括产品标识和生产标识,具有唯一性、稳定性和可扩展性(见图18)。
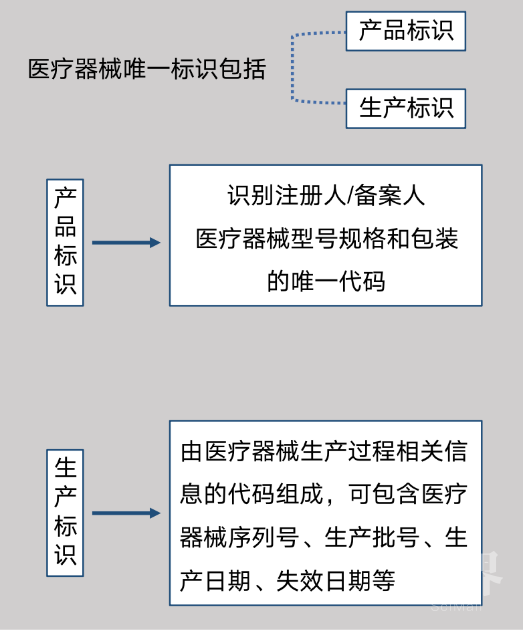
图18 医疗器械唯一标识所含内容
2019年7月,国家药监局会同国家卫健委联合开展唯一标识系统试点工作,有利于运用信息化手段实现对医疗器械在生产、经营和使用各环节的快速、准确识别,有利于实现产品监管数据的共享和整合,有利于创新监管模式,提升监管效能,有利于加强医疗器械全生命周期管理,实现政府监管与社会治理相结合,形成社会共治的局面,进一步提升公众用械安全有效的保障水平。据悉,第一批唯一标识实施工作将于2021年1月1日实施。建议成渝地区各地要积极开展唯一标识政策宣贯培训,重点推进唯一标识在医药、医疗、医保“三医”领域的衔接应用,为推进成渝地区医疗器械数字化管理工作保驾护航。



 微信公众号
微信公众号
 下载app
下载app
 京公网安备 11010202008974号
京公网安备 11010202008974号